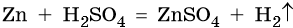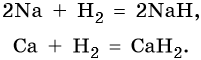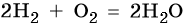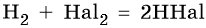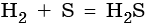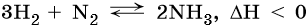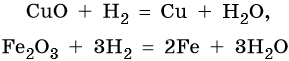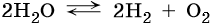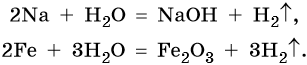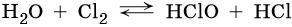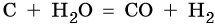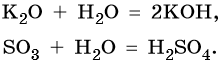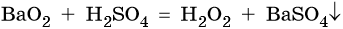- Водород
- Уроки по неорганической химии для подготовки к ЕГЭ
- 1. Взаимодействие простых веществ с водородом
- 2» name=»comp_H2«>2. Взаимодействие сложных веществ с водородом
- Водород: химия водорода и его соединений
- Водород
- Положение в периодической системе химических элементов
- Электронное строение водорода
- Физические свойства
- Соединения водорода
- Способы получения
- Химические свойства
- Применение водорода
- Водородные соединения металлов
- Способы получения
- Химические свойства
- Летучие водородные соединения
- Строение и физические свойства
- Способы получения силана
- Способы получения аммиака
- Способы получения фосфина
- Способы получения сероводорода
- Химические свойства силана
- Химические свойства фосфина
- Химические свойства сероводорода
- Химические свойства прочих водородных соединений
- Физические свойства
- Химические свойства
Водород
Водород занимает особое положение в Периодической системе химических элементов Д.И. Менделеева. По числу валентных электронов, способности образовывать в растворах гидратный ион H + он сходен со щелочными металлами, и его следует поместить в I группу. По числу электронов, необходимых для завершения внешней электронной оболочки, значению энергии ионизации, способности проявлять отрицательную степень окисления, малому атомному радиусу водород следует поместить в VII группу периодической системы. Таким образом, размещение водорода в той или иной группе периодической системы в значительной мере условно, но в большинстве случаев его помещают в VII группу.
Электронная формула водорода 1s 1 . Единственный валентный электрон находится непосредственно в сфере действия атомного ядра. Простота электронной конфигурации водорода отнюдь не означает, что химические свойства этого элемента просты. Напротив, химия водорода во многом отличается от химии других элементов. Водород в своих соединениях способен проявлять степени окисления +1 и –1.
Существует большое количество методов получения водорода. В лаборатории его получают взаимодействием некоторых металлов с кислотами, например:
Водород можно получить электролизом водных растворов серной кислоты или щелочей. При этом происходит процесс выделения водорода на катоде и кислорода на аноде.
В промышленности водород получают главным образом из природных и попутных газов, продуктов газификации топлива и коксового газа.
Простое вещество водород (H2) представляет собой горючий газ без цвета и запаха. Температура кипения –252,8 °C. Водород в 14,5 раз легче воздуха, мало растворим в воде.
Молекула водорода устойчива, обладает большой прочностью. Из-за высокой энергии диссоциации (435 кДж/моль) распад молекул H2 на атомы происходит в заметной степени лишь при температуре выше 2000 °C.
Для водорода возможны положительная и отрицательная степени окисления, поэтому в химических реакциях водород может проявлять как окислительные, так и восстановительные свойства. В тех случаях, когда водород выступает в качестве окислителя, он ведет себя подобно галогенам, образуя аналогичные галогенидам гидриды (гидридами называют группу химических соединений водорода с металлами и менее электроотрицательными, чем он, элементами):
По окислительной активности водород существенно уступает галогенам. Поэтому ионный характер проявляют лишь гидриды щелочных и щелочноземельных металлов. Ионные, а также комплексные гидриды, например, являются сильными восстановителями. Их широко используют в химических синтезах.
В большинстве реакций водород ведет себя как восстановитель. При нормальных условиях водород не взаимодействует с кислородом, однако при поджигании реакция протекает со взрывом:
Смесь двух объемов водорода с одним объемом кислорода называют гремучим газом. При контролируемом горении происходит выделение большого количества тепла, и температура водородно-кислородного пламени достигает 3000 °C.
Реакция с галогенами протекает, в зависимости от природы галогена, по-разному:
С фтором такая реакция идет со взрывом даже при низких температурах. С хлором на свету реакция также протекает со взрывом. С бромом реакция идет значительно медленнее, а с йодом не доходит до конца даже при высокой температуре. Механизм этих реакций радикальный.
При повышенной температуре водород взаимодействует с элементами VI группы — серой, селеном, теллуром, например:
Очень важной является реакция водорода с азотом. Эта реакция обратима. Для смещения равновесия в сторону образования аммиака используют повышенное давление. В промышленности данный процесс осуществляют при температуре 450–500 °C в присутствии различных катализаторов:
Водород восстанавливает многие металлы из оксидов, например:
Данную реакцию используют для получения некоторых чистых металлов.
Огромную роль играют реакции гидрирования органических соединений, которые широко используют как в лабораторной практике, так и в промышленном органическом синтезе.
Сокращение природных источников углеводородного сырья, загрязнение окружающей среды продуктами сгорания топлива повышают интерес к водороду как к экологически чистому топливу. Вероятно, водород будет играть важную роль в энергетике будущего.
В настоящее время водород широко применяют в промышленности для синтеза аммиака, метанола, гидрогенизации твердого и жидкого топлива, в органическом синтезе, для сварки и резки металлов и т. д.
Вода H2O, оксид водорода, является важнейшим химическим соединением. При нормальных условиях вода — бесцветная жидкость, без запаха и вкуса. Вода — самое распространенное вещество на поверхности Земли. В человеческом организме содержится 63–68% воды.
Физические свойства воды во многом являются аномальными. При нормальном атмосферном давлении вода кипит при 100 °C. Температура замерзания чистой воды 0 °C. B отличие от других жидкостей плотность воды при охлаждении возрастает не монотонно, а имеет максимум при +4 °C. Теплоемкость воды очень высока и составляет 418 кДж/моль·K. Теплоемкость льда при 0 °C составляет 2,038 кДж/моль·K. Аномально высокой является теплота плавления льда. Электропроводность воды очень мала. Аномальные физические свойства воды объясняют ее строение. Валентный угол H–O–H равен 104,5°. Молекула воды представляет собой искаженный тетраэдр, в двух вершинах которого располагаются атомы водорода, а две другие заняты орбиталями неподеленных пар электронов атома кислорода, не участвующих в образовании химических связей.
Вода является стабильным соединением, ее разложение на кислород и водород происходит лишь под действием постоянного электрического тока или при температуре около 2000 °C:
Вода непосредственно взаимодействует с металлами, стоящими в ряду стандартных электронных потенциалов до водорода. Продуктами реакции в зависимости от природы металла могут быть соответствующие гидроксиды и оксиды. Скорость реакции в зависимости от природы металла также изменяется в широких пределах. Так, натрий вступает в реакцию водой уже при комнатной температуре, реакция сопровождается выделением большого количества тепла; железо реагирует с водой при температуре 800 °С:
Вода может вступать в реакцию со многими неметаллами. Так, при обычных условиях вода обратимо взаимодействует с хлором:
При повышенной температуре вода взаимодействует с углем с образованием так называемого синтез-газа — смеси оксида углерода (II) и водорода:
При обычных условиях вода реагирует со многими основными и кислотными оксидами с образованием оснований и кислот соответственно:
Реакция идет до конца, если соответствующее основание или кислота растворимы в воде.
Пероксид водорода (H2O2) представляет собой бесцветную жидкость, очень неустойчивую при комнатной температуре. Концентрированные растворы пероксида водорода взрывоопасны. В лаборатории H2O2 получают с помощью обменной реакции между пероксидом бария и концентрированной серной кислотой:
В химических реакциях H2O2 может проявлять свойства как окислителя, так и восстановителя, например:
Источник
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
1. Взаимодействие простых веществ с водородом
1) Из металлов только щелочные и щелочноземельные металлы реагируют с водородом с образованием гидридов (степень окисления атомов водорода –1):
2Na + H2 → 2NaH (гидрид натрия)
Ca + H2 → CaH2 (гидрид кальция)
Fe + H2 → реакция не идет
Cu + H2 → реакция не идет
2) Все неметаллы реагируют с водородом (кроме P, B, Si и благородных газов), образуя летучие водородные соединения:
Примеры водородных соединений:
| Валентность: | IV | III | II | I |
| Летучее водородное соединение: | NH3 (аммиак) | H2O (вода) | HF (фтороводород) | |
| SiH4 (силан) | PH3 (фосфин) | H2S (сероводород) | HCl (хлороводород) |
CH4 — бесцветный газ без запаха
SiH4 — бесцветный газ с неприятным запахом
NH3 — бесцветный газ с резким характерным запахом
PH3 — бесцветный, ядовитый газ с неприятным запахом (возникающим из-за примесей)
H2S — бесцветный газ с характерным неприятным запахом тухлых яиц
HF — бесцветный, токсичный газ с резким запахом
HCl — бесцветный, ядовитый газ с резким запахом, дымящий во влажном воздухе.
Так как P, B и Si не взаимодействуют с водородом, их водородные соединения получают косвенным способом.
2» name=»comp_H2«>2. Взаимодействие сложных веществ с водородом
1) Необходимо помнить, что такие оксиды, как ZnO, CuO, PbO, FeO, Fe2O3 (и некоторые другие оксиды малоактивных металлов, т.е. стоящих в ряду активностей после Al) взаимодействуют с водородом с восстановлением соответствующего металла:
2) Оксиды таких неметаллов, как азот и углерод также взаимодействуют с водородом:
Источник
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом кремния:
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник