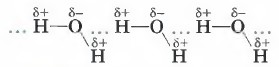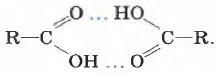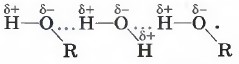§ 6. Водородная химическая связь
Рассмотрением водородной связи мы завершаем наше знакомство с типами химической связи. И это не случайно.
Во-первых, водородная связь — это частный случай межмолекулярного взаимодействия. Энергия такой связи примерно в 10 раз меньше, чем ковалентных и ионных химических связей, и составляет всего лишь 4—40 кДж/моль, т. е. вписывается в энергетическую характеристику межмолекулярных сил.
Во-вторых, рассмотрение водородной связи позволит сравнить эту химическую связь с другими типами и тем самым обобщить наши представления о природе химической связи вообще.
В-третьих, это самая значимая на нашей планете химическая связь, ибо она определяет структуру соединений, которые являются носителями жизни на Земле (белки и нуклеиновые кислоты), отвечают за хранение и воспроизведение наследственной информации живых организмов.
Все рассмотренные ранее типы химической связи (вспомните какие) имеют названия, в основу которых положены следующие химические понятия: «ионы», «атомы», «металлы». А водородная связь — специфический термин, связанный с конкретным химическим элементом — водородом. Очевидно, это связано с особенностью строения атома водорода, имеющего один- единственный валентный электрон. Участвуя в образовании химической связи, этот электрон обнажает крохотное ядро атома водорода, представляющее собой не что иное, как обыкновенный протон.
Образованием межмолекулярной водородной связи объясняется тот факт, что даже вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода; спирты — метанол, этанол, пропанол; карбоновые кислоты — муравьиная, уксусная) или легко сжижаемые газы (аммиак, фтороводород).
Механизм образования водородной связи состоит в электростатическом притяжении атома водорода, имеющего частичный положительный заряд, и атома кислорода (фтора или азота), имеющего частичный отрицательный заряд.
В образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободными орбиталями атомов водорода и неподелён- ными электронными парами атомов кислорода (фтора или азота). Например, вода ассоциирована в жидкость за счёт водородных связей, возникающих между молекулами-диполями.
В жидкой воде образуются водородные связи между множеством молекул. А вот молекулы карбоновых кислот наиболее устойчивы в виде димеров, также образованных водородными связями:
Алхимическое правило растворения «подобного в подобном» объясняется образованием водородной связи между молекулами растворителя и молекулами растворённого вещества.
Так, метиловый и этиловый спирты, этиленгликоль и глицерин, уксусная и муравьиная кислоты неограниченно растворяются в воде, например:
Способность некоторых газов, например аммиака, за счёт образования водородных связей
легко сжижаться (при давлении 0,9 МПа и комнатной температуре) и вновь переходить в газообразное состояние с поглощением теплоты позволяет использовать их в качестве хладагентов в промышленных холодильных установках (рис. 30).
Источник
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
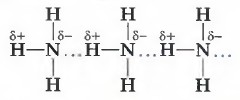
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
- Межмолекулярная водородная связь образуется между различными молекулами веществ. Обязательным условием образования такого вида водородной связи — это наличие водорода в одной молекуле и одного из элементов с высокой электроотрицательностью в другой молекуле (например, F, O, N, Cl, S). Связь может возникать как между одинаковыми молекулами, так и между разными. Например, это могут быть молекулы аммиака, воды, фтороводорода, спиртов (например, метанол, этанол), карбоновых кислот (например, муравьиная, уксусная кислоты), аминокислот в молекуле белка:
- Внутримолекулярная водородная связь образуется внутри одной молекулы. Условие образования внутримолекулярной водородной связи — это наличие в одной молекуле и атомов водорода и атомы с высокой электроотрицательностью. Такая связь может возникнуть, например, у многоатомных спиртов (этиленгликоль, глицерин), белков, углеводов, оксикислот (салициловая кислота) и других органических соединений:
Характеристика водородной связи
Водородная связь характеризуется
- Направленностью в пространстве и насыщаемостью.
- Водородная связь оказывает большое влияние на свойства многих веществ, особенно в биологических системах. Например, водородная связь определяет довольно некомпактную упаковку молекул воды во льду, поэтому плотность льда меньше плотности жидкой воды. Наличие водородной связи в веществах способствует аномальному росту их температур кипения и плавления.
- Водородная связь — слабая связь. Величина энергии водородной связи обычно лежит в пределах от 4 до 25 кДж/моль, это всего несколько процентов от величины энергии обычной химической связи. Теперь предположим, что водородная связь возникает в результате электростатического взаимодействия между диполем связи X-H и неподеленной электронной порой на атоме Y. Тогда прочность водородной связи увеличивается в ряду:
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Источник
Водородная связь.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Молекула салициловой кислоты.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.
Источник
Водородные связи вода аммиак этанол
Из предложенного перечня выберите два вещества, для которых характерна водородная связь.
Запишите в поле ответа номера выбранных соединений.
Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (,
и
), одной молекулы и атомом эле-мента с высокой электроотрицательностью (
,
,
) другой молекулы. Например, между атомом водорода одной молекулы фтороводорода и атомом фтора другой молекулы фтороводорода образуется водородная связь.
Среди предложенных веществ кислород в составе группы −ОН присутствует только в молекулах спиртов и фенолов, поэтому среди предложенных веществ водородная связь возможна между молекулами спиртов и фенолов. Остальные вещества относятся к углеводородам и не способны к образованию водородных связей.
Из предложенного перечня выберите два вещества, в которых между молекулами образуется водородная связь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Водородная связь — это особый вид связи между частично положительно заряженным водородом связанным с электроотрицательным атомом (,
или
) одной молекулы (или, для внутримолекулярной связи, одной части молекулы) и частично отрицательно заряженным атомом азота, кислорода или фтора другой молекулы (или другой части молекулы).
1. В молекуле метана электроотрицательности атомов водорода и углерода близки, поэтому практически нет перераспределения заряда.
2. В молекуле фтороводорода есть частично отрицательно заряженный фтор и частично положительно заряженный водород, что позволяет образовывать водородную связь.
3. Молекула водорода содержит ковалентную неполярную связь, поэтому нет перераспределения заряда
4. В молекуле ацетальдегида электроотрицательности атомов водорода и углерода близки, поэтому практически нет перераспределения заряда, а кислород имеет сильный отрицательный заряд.
5. В молекуле перекиси водорода есть частично отрицательно заряженный кислород и частично положительно заряженный водород, что позволяет образовывать водородную связь.
Источник