- Взаимодействие активных металлов с водой реакция
- Взаимодействие воды с металлами
- Как они взаимодействуют?
- Пример взаимодействие активных металлов с водой
- Какие металлы реагируют с водой?
- Все химические реакции, которые необходимы для успешной сдачи ОГЭ
- Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
- Правило 1.2. Взаимодействие оксидов с водой
- Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
Взаимодействие активных металлов с водой реакция
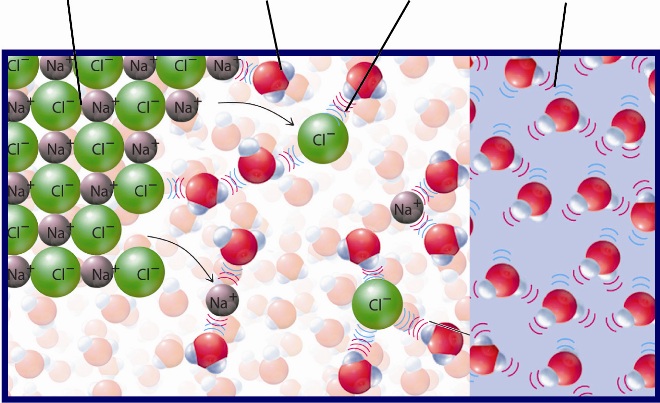
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
Вода является очень слабым электролитом, однако в процессе диссоциации ее молекул, хоть и в небольшом количестве, образуются ионы водорода:
H2O 
Образующиеся ионы Н + способны окислять атомы металлов, расположенных в ряду активности до водорода, восстанавливаясь до молекулярного водорода:
Следовательно, продуктом восстановления при взаимодействии любого металла (если он стоит в ряду активности левее водорода) с водой будет газообразный водород. Состав же продукта окисления зависит от активности металла и условий протекания реакции.
Активные металлы энергично взаимодействуют с водой при обычных условиях по схеме:
Продуктом окисления металла является его гидроксид – Me ( OH ) n (где n -степень окисления металла).
Металлы средней активности взаимодействуют с водой при нагревании по схеме:
2Me + nH2O 
Продукт окисления в таких реакциях – оксид металла Me 2 On (где n -степень окисления металла).
3 Fe + 4 H 2 O пар 
Источник
Взаимодействие воды с металлами
Вода обладает разнообразными свойствами. Она может замерзать. Превращаться в пар. С водой человек дружит с рождения. Помимо всего этого она так же может вступать во взаимодействие с металлом. Как? Читайте нашу статью, и Вы узнаете об этом! Вступая в контакт с жидкостью, металлы способны давать самые удивительные реакции! Например: чтобы насытить воду железом её настаивают несколько часов на железе, после чего употребляют во внутрь, а если бросить в стакан с водой щелочной металл то произойдет взрыв. Существует множество разнообразных металлов и каждый случай взаимодействия уникален! Проводите опыты, делайте собственные открытия, а посвятить Вас в основы взаимодействия воды с металлами поможет наша статья!
Как они взаимодействуют?
Взаимодействие металла с водой может происходить по разному, в зависимости от металла и воды. Каждый металл обладает своими неповторимыми особенностями. Так же, может показаться, что формулы очень сложные, однако со временем Вы легко научитесь их читать. Если алюминий, железо вступает в активные реакции с водой, то это значит что в нем присутствуют образующиеся соли. Он окисляется ионами водорода. Проследить это можно по формуле и записать в виде сокращенной формулировки Me + nH + → Me n+ + H2↑
Вступая в реакцию с водой, в исключительных ситуациях образуются гидроксиды. Очень активно в спокойных условиях вступают в реакцию с влагой щелочные металлы, например Литий (Li), натрий (Na) , Калий (К), Рубидий (Rb) , Цезий (Cs), Франций (FR).
Щелочные металлы вступают в очень бурную реакцию с водой. Отследить процесс взаимодействия металлов с водой можно по формулам:
NaH + HCl ® NaCl + H2

Активные металлы способны вступать во взаимодействие с водой при обычных условиях согласно схеме: 2Me + 2nH2O → 2Me(OH)n + nH2 .Итогом окисления как правило становится гидроксид Me(OH)n (где n-степень окисления металла).
Приведем пример: Ca + 2H2O → Ca(OH)2 + H2↑
Металлы же со средней степенью активности вступают во взаимодействие с водой при нагревании по схеме: 2Me + nH2O Me2On + nH2 . Итогом такой реакции становится появление оксида металла. Его формула — Me2On (где n-степень окисления металла) .
Пример взаимодействие активных металлов с водой
Металлы так же используют при изготовлении кухонной утвари. К примеру алюминиевая сковородка, металлический корпус чайника, лопасти блендера. Тут важна стойкость металла. Самой известной реакцией металла на воду является окисление самой обыкновенной стали на воздухе и в воде. Железо в таком случае разрушается, ржавеет. Происходящие при этом процессы являются весьма сложными и удивительным природным процессом. Если же окисление происходит в морской воде, то процесс ускоряется, этому способствует определенная концентрация соли находящаяся в составе воды.
Противостоять образованию ржавчины можно при использовании разнообразных лаков, призванных защитить от коррозии металла и перехитрить химические законы! Так же, вода вступая в реакцию с нагретым металлом способна образовывать накипь.
Это явление можно наблюдать на частях чайника сделанных из алюминия или стали, который давно не чистили. Такой чайник достаточно прокипятить с лимонной кислотой и он снова будет как новый!
Иногда образование накипи не связано с активными металлами, а имеет немного другую природу. В частности, накипь может появляться из-за солей жесткости в воде. В таком случае нужно купить качественный фильтр для жесткой воды.
Источник
Какие металлы реагируют с водой?
Прежде всего следует запомнить, что металлы делят в целом на три группы:
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
3) Малоактивные металлы: металлы, расположенные в ряду активности правее водорода.
В первую очередь нужно запомнить, что малоактивные металлы (т.е. те, что расположены после водорода) с водой не реагируют ни при каких условиях.
Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например:
Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим:
Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония:
Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 о С). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород:
Fe + H2O = FeO + H2 (в зависимости от степени нагрева)
Источник
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
SiO2 + H2O → реакция не идет.
Источник
Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
2Al + 3Cl 2 = 2AlCl 3
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Ca + N 2 = t, °C = Ca 3 N 2
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
2Al + 6H 2 O = 2Al(OH) 3 +3H 2
Магний (в горячей воде):
Mg + 2H 2 O = t°C = Mg(OH) 2 +H 2
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3Fe + 4H 2 O = t°C = FeO‧Fe 2 O 3 + 4H 2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
2H 2 SO 4 (конц.) + Cu = t°C = CuSO 4 + 2H 2 O + SO 2 ↑
8Na 0 + 5H 2 +6 SO 4 = 4Na 2 +1 SO 4 + H 2 S -2 ↑ + 4H 2 O
HNO 3 + Me = Нитрат + H 2 O + Х
4HNO 3 (k) + Cu = Cu(NO 3 ) 2 + 4H 2 O + 2NO 2 ↑
8HNO 3 (p) + 3Cu = 3Cu(NO 3 ) 2 + 4H 2 O + 2NO↑
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
Zn + 4HNO 3 (конц. горячий) = t˚C = Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Fe + CuCl 2 = FeCl 2 + Cu
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Источник