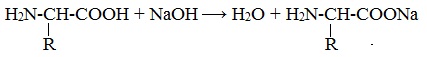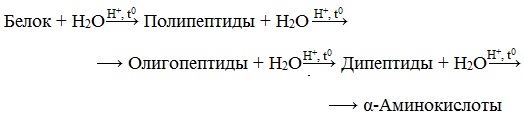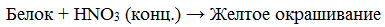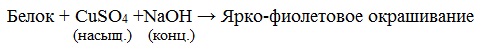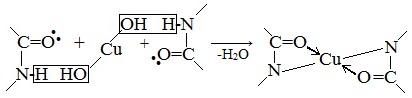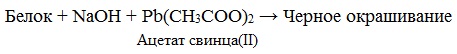- Белки
- Структуры белков
- Химические свойства белков
- Качественные реакции на белки
- Денатурация белка
- Взаимодействие белка с водой реакция
- 1. Амфотерные свойства белков
- 2. Денатурация белка (необратимое осаждение, свертывание)
- 3. Гидролиз белков
- 4. Цветные (качественные) реакции на белки
- Химия. 10 класс
- § 48. Белки
- Белки
- Взаимодействие воды с белками. Гидротация.
- Роль воды в развитии микроорганизмов на сырье и пищевых продуктах.
Белки
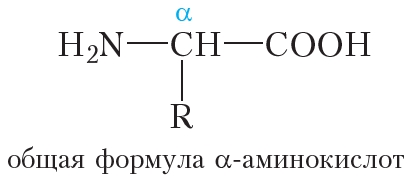
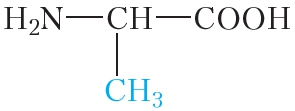
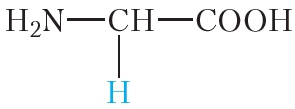
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
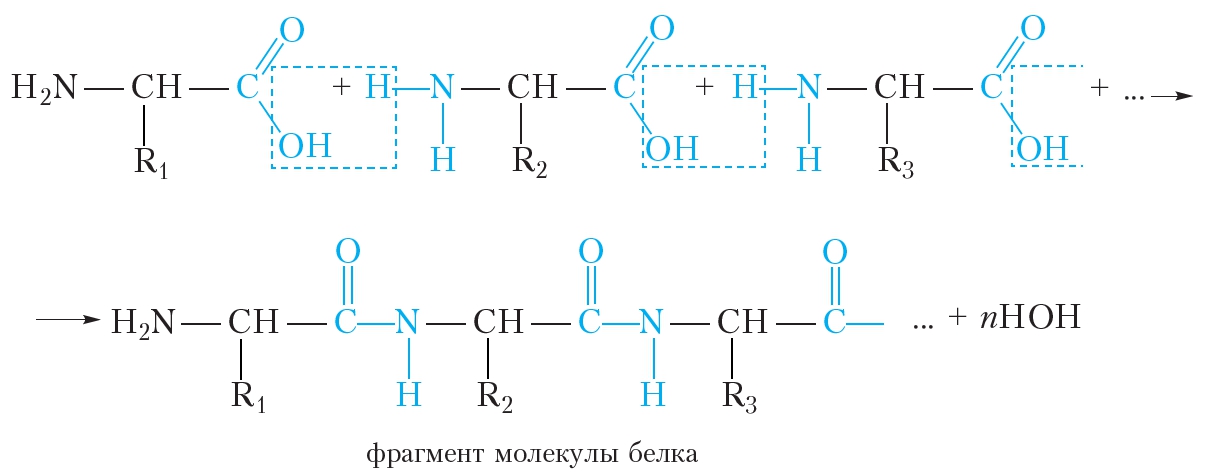
Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Структуры белков
| Первичная структура — последовательность α-аминокислотных звеньев в полипептидной цепи | Вторичная структура – спиральная структура полипептидной цепи, закрепленная водородными связями между группами N-H и С=О |
 |  |
| Третичная структура – определенная форма спирали в пространстве, образованная с помощью дисульфидных мостиков -S-S-, водородных связей и других взаимодействий | Четвертичная структура — объединение нескольких белковых макромолекул в так называемые глобулы (бывает не у всех белков) |
 |  |
Химические свойства белков
Качественные реакции на белки
- Биуретовая реакция – фиолетовое окрашивание при действии на белки свежеосажденного гидроксида меди (II).
- Ксантопротеиновая реакция – желтое окрашивание при действии на белки концентрированной азотной кислоты.
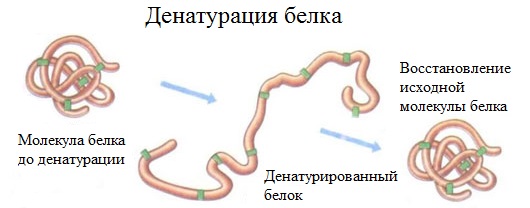
Денатурация белка
Это разрушение структуры белка при нагревании, изменении кислотности среды, действии излучения, спирта, тяжелых металлов, радиации.
Пример денатурации — свертывание яичных белков при варке яиц.
Денатурация бывает обратимой и необратимой.
- При обратимой денатурации первичная структура белка не разрушается.
- Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
- При необратимой денатурации происходит также гидролиз белка — необратимое разрушение первичной структуры в кислом или щелочномрастворе с образованием аминокислот или более коротких пептидных фрагментов.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Источник
Взаимодействие белка с водой реакция
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
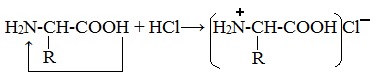
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
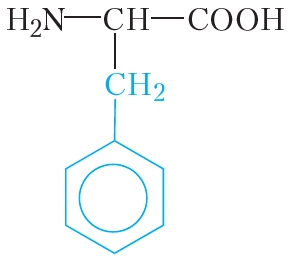
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
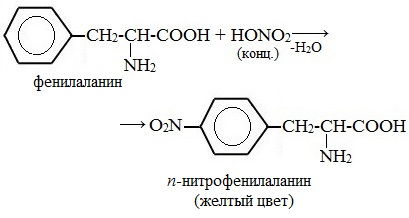
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
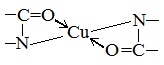
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
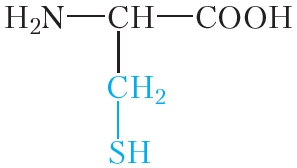
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Источник
Химия. 10 класс
§ 48. Белки
Белки
Молекулы белков построены из остатков α-аминокислот:
Образование молекулы белка из α-аминокислот можно представить следующей схемой:
Видно, что в молекулах белков аминокислотные остатки соединены пептидными связями, следовательно, белки являются полипептидами.
Молекулы белков обычно содержат сотни и даже тысячи аминокислотных остатков. При этом наиболее часто в составе белков встречаются остатки 20 разных аминокислот (табл. 48.1).
Таблица 48.1. Некоторые аминокислоты, остатки которых входят в состав белков

Остатки этих аминокислот расположены в макромолекуле белка в строго определённой последовательности (рис. 48.1).

На первый взгляд может показаться, что использование 20 разных аминокислот для построения молекул белков существенно ограничивает разнообразие белковых структур. На самом деле количество комбинаций, которое можно составить, используя для построения полипептидных цепей 20 разных аминокислот, практически бесконечно. Например, если полипептидная цепь будет состоять из 100 аминокислотных остатков, то, используя для её построения 20 различных аминокислот, можно составить 20 100 комбинаций!
Источник
Взаимодействие воды с белками. Гидротация.
Белки — амфотерные электролиты. При определенном рН среды (изоэлектрическая точка) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одна из основных констант белка. Белки в этой точке электронейтральны, а их вязкость и растворимость наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул широко используется для выделения их из растворов, например в технологии получения белковых продуктов.
Гидратация. Белки связывают воду, т. е. проявляют гидрофильные свойства. При этом они набухают, увеличивается их масса и объем. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположённые на поверхности белковой макромолекулы гидрофильные СО—NН (пептидная связь), аминные NH

Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации, а следовательно, способствует устойчивости растворов белка и препятствует его осаждению.
В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению их в осадок. При изменении рН среды макромолекула белка становится заряженной, и его гидратационная способность меняется. При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не обладают текучестью, они упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока, образуя растворы с невысокой концентрацией).
Гидрофильные свойства белков, т. е. их способность набухать, образовывать студни, стабилизировать суспензии, эмульсии и пены имеют большое значение в биологии и пищевой промышленности. Очень подвижным студнем, построенным в основном из молекул белка, является цитоплазма — полужидкое содержимое клетки. Сильно гидратированный студень — сырая клейковина, выделенная из пшеничного теста, она содержит до 65 % воды. Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, при изготовлении мучных кондитерских изделий, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Роль воды в развитии микроорганизмов на сырье и пищевых продуктах.
Стабильность продуктов питания зависит от активности воды. Показатель активности воды характеризует доступность влаги в продукте для развития микроорганизмов и протекания микробиологических и биохимических процессов. Показатель водной активности варьирует в пределах от 0 до 1: 0 — абсолютно обезвоженное вещество; 1 — показатель для дистиллированной воды.
По величине активности воды все пищевые продукты делятся на три группы:
— пищевые продукты с высокой влажностью (ПВВ, а
— пищевые продукты с промежуточной влажностью (ППВ, а
— пищевые продукты с пониженной влажностью (ПНВ, а
На хранимоспособность продуктов большое влияние оказывает показатель водной активности. При равных условиях хранения максимальную стойкость к порче различного происхождения проявляют ПНВ, затем ППВ и ПВВ.
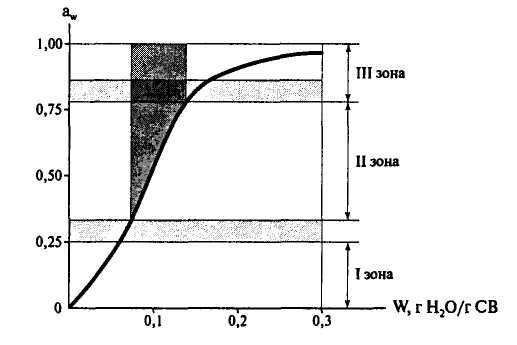
Существуют кривые, показывающие связь между содержанием влаги в пищевых продуктах и активностью воды в них при постоянной температуре (масса воды, г Н
Рис. 1. Изотерма сорбции влаги для области низкого содержания влаги в пищевых продуктах
Установлено, что продукты, имеющие показатель активности воды ниже чем 0,7, могут длительное время сохраняться без микробиологической порчи. Микроорганизмы в продуктах могут развиваться при различных значениях активности воды. Самыми влаголюбивыми являются бактерии. Для них показатель активности воды 0,94÷0,90, для дрожжей показатель активности 0,88÷0,85. Это значение показателя характерно для большинства плесневых грибов, т. е. это среднее значение показателя активности воды.
Наиболее устойчивыми к низкому содержанию влаги являются некоторые плесневые грибы, например рода Aspergillus: показатель активности воды 0,65÷0,8.
Источник