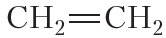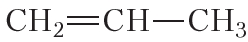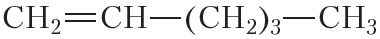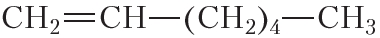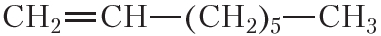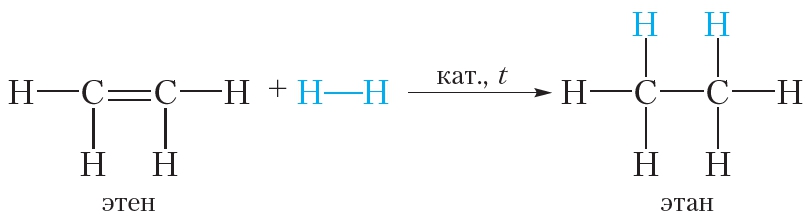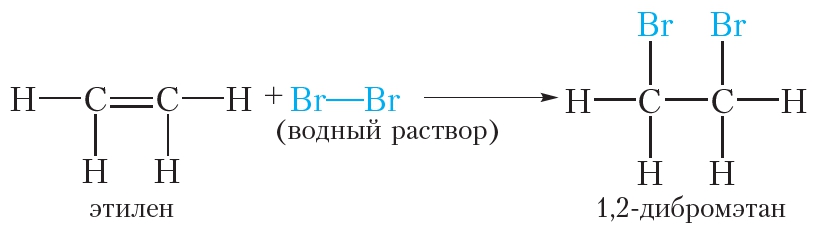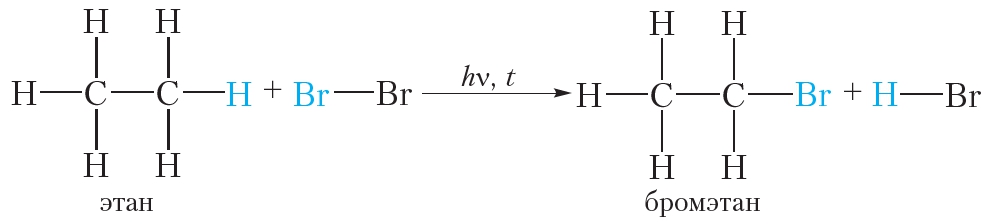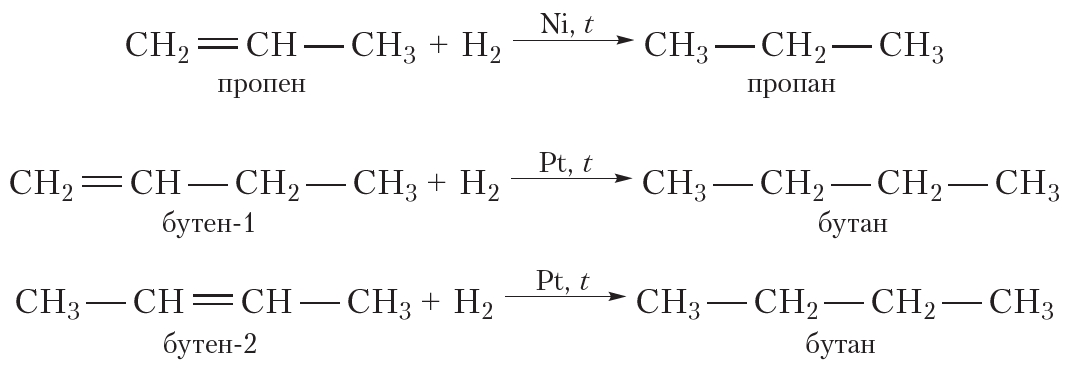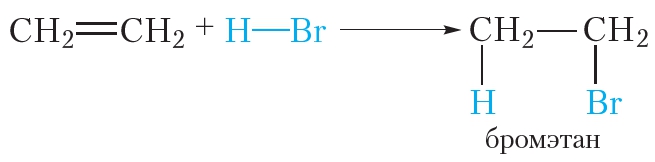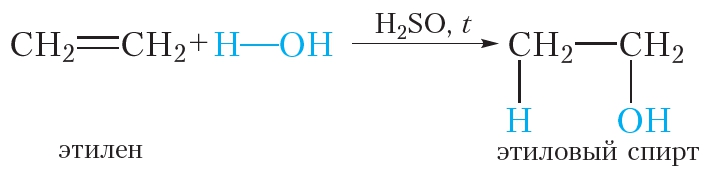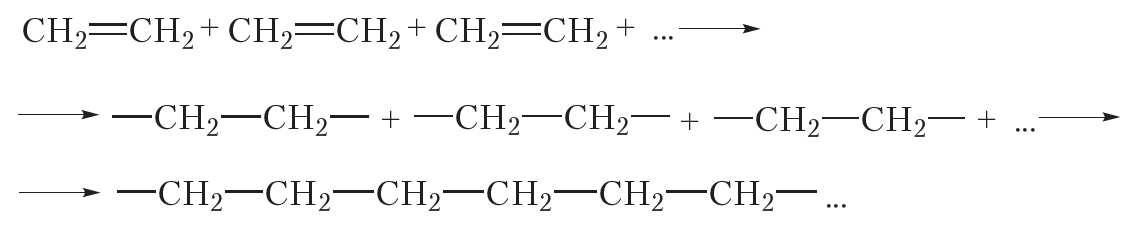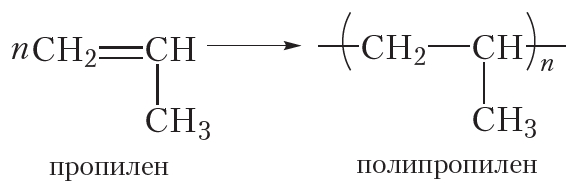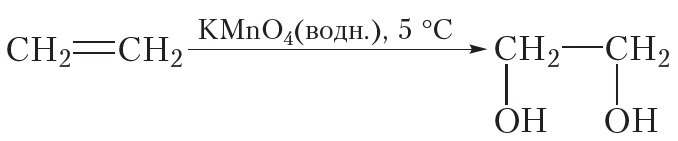- Взаимодействие этена с водой является реакцией
- Физические и химические свойства этилена
- Химические свойства этилена
- Физические свойства этилена
- Получение этилена
- Применение этилена
- Примеры решения задач
- § 15. Физические и химические свойства алкенов
- Оглавление
- Физические свойства
- Химические свойства
- Реакции присоединения
- Реакция полимеризации
- Реакции окисления
- Вопросы и задания
Взаимодействие этена с водой является реакцией
Взаимодействие этилена с водой протекает
1) по цепному свободнорадикальному механизму
2) без катализатора
3) с промежуточным образованием частицы
4) с разрывом -связи в молекуле этилена
5) с образованием этанола
6) с преимущественным образованием этиленгликоля
Молекула воды полярна и ей не характерны радикальные реакции — к этилену сначала присоединяется катион водорода (с промежуточным образованием частицы ), потом гидроксид-анион. При этом получается этиловый спирт. Таким образом, верно, что 3) с промежуточным образованием частицы
, 4) с разрывом
-связи в молекуле этилена, 5) с образованием этанола. Катализатором для гидратации этилена может являться концентрированная серная кислота.
Источник
Физические и химические свойства этилена
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp 2 -гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
Галогенирование этилена возможно также при нагревании (300
Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление этилена кислородом при 200
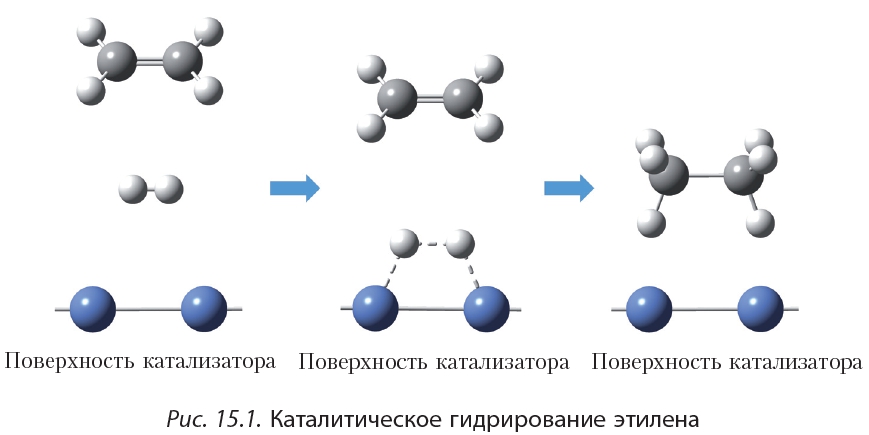
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
— дегидратация этилена при его нагревании с серной кислотой (t >150 
— дегидрирование этана при нагревании (500
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров (полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
| Задание | Осуществите ряд превращений этан → этен (этилен) → этанол → этен → хлорэтан → бутан. |
| Решение | Для получения этена (этилена) из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: |
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Вычислите сколько литров и граммов этилена можно получить из 160 мл этанола, плотность которого равна 0,8 г/мл. |
| Решение | Этилен из этанола можно получить по реакции дегидратации, условием протекания которой является присутствие минеральных кислот (серной, фосфорной). Запишем уравнение реакции получения этилена из этанола: |
Найдем массу этанола:
Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола:
Могласно уравнению реакции v(C2H5OH) : v(C2H4) = 1:1, следовательно, v(C2H4) = v(C2H5OH) = 2,78 моль. Молярная масса (молекулярная масса одного моль) этилена, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 28 г/моль. Найдем массу и объем этилена:
Источник
§ 15. Физические и химические свойства алкенов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 15. Физические и химические свойства алкенов |
| Напечатано:: | Гость |
| Дата: | Среда, 20 Октябрь 2021, 22:46 |
Оглавление
Физические свойства
По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов углерода в молекуле. Так, алкены с числом атомов углерода в молекуле 2—4 при комнатной температуре являются бесцветными газами. Алкены с числом атомов углерода в молекуле от 5 до 17 — жидкости. Алкены с ещё бóльшим числом атомов углерода в молекуле (от 18 и более) представляют собой твёрдые вещества. Температуры кипения некоторых алкенов неразветвлённого строения приведены в таблице 15.1.
Таблица 15.1. Температуры кипения алкенов
Температура кипения (tкип, °С)
Так же, как и алканы, алкены нерастворимы в воде, но хорошо растворяются в органических растворителях.
Плотность алкенов меньше, чем у воды.
Химические свойства
Благодаря наличию в молекуле π-связи реакционная способность алкенов намного выше, чем у алканов. Напомним, что для алканов характерны реакции замещения. Для алкенов характерными являются реакции присоединения:
Эти реакции сопровождаются разрывом π-связи, так как она менее прочная, чем σ-связь.
В реакции присоединения алкены вступают в более мягких условиях, чем алканы в реакции замещения. Реакции замещения для алкенов нехарактерны.
Реакции присоединения
1. Галогенирование. Присоединение галогенов
Алкены так же, как и алканы, взаимодействуют с галогенами. Однако в случае алкенов происходит реакция присоединения, а не замещения. Сравним эти реакции.
Бромирование этилена (реакция присоединения ):
Бромирование этана (реакция замещения ):
Этилен реагирует с водным раствором брома (бромной водой) при обычных условиях, в то время как реакция этана с бромом возможна только в жёстких условиях — при нагревании или ультрафиолетовом облучении.
При пропускании этилена через бромную воду протекает реакция присоединения брома по двойной связи. В результате оранжевый раствор брома обесцвечивается.
В молекуле этана нет двойных связей, поэтому при пропускании этана через бромную воду химическая реакция не протекает и раствор брома остаётся оранжевым.
Следовательно, реакция с бромной водой является качественной реакцией на двойную связь.
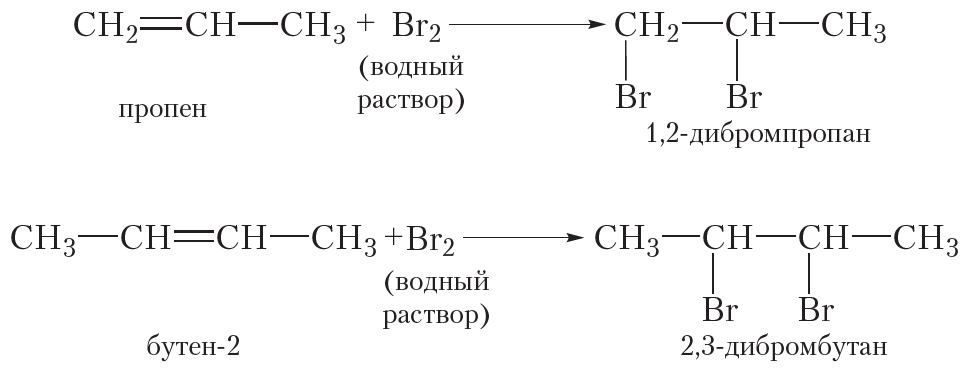
Подобно этилену, другие алкены легко присоединяют бром, обесцвечивая бромную воду:
2. Гидрирование. Присоединение водорода
Присоединение водорода к органическому веществу называется реакцией гидрирования. При обычных условиях алкены не присоединяют водород. Для протекания реакции необходим катализатор (Pt или Ni).
В результате гидрирования алкенов образуются алканы. В начале данного параграфа приведено уравнение реакции гидрирования этена. Приведём уравнения реакций гидрирования некоторых других алкенов:
Как вы уже знаете, катализатор ускоряет протекание химической реакции, но сам при этом не расходуется. Роль катализатора в реакции гидрирования заключается в том, чтобы ослабить химическую связь в молекуле водорода и, таким образом, активировать эту молекулу для реакции присоединения:
3. Гидрогалогенирование. Присоединение галогеноводородов
Алкены могут вступать в реакции присоединения не только с простыми, но и со сложными веществами. Например, этилен легко присоединяет бромоводород:
Реакции присоединения галогеноводородов к органическим веществам называются реакциями гидрогалогенирования. Эти реакции протекают при обычных условиях.
4. Гидратация. Присоединение воды
Гидратацией называется реакция присоединения воды к органическому веществу. При нагревании в присутствии катализатора (H2SO4) этилен присоединяет воду. При этом образуется этиловый спирт:
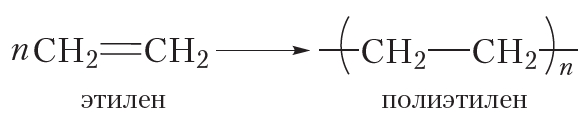
Реакция полимеризации
За счёт раскрытия двойных связей отдельные молекулы этилена могут соединяться друг с другом, образуя длинные цепи. Схематично этот процесс можно изобразить так:
В результате соединения сотен или даже тысяч молекул этилена образуется одна гигантская молекула — полимер. Протекающая реакция называется реакцией полимеризации.
Более кратко процесс полимеризации этилена можно выразить следующим уравнением:
Полимеризоваться могут и другие алкены, в частности пропилен:
Исходное вещество в реакции полимеризации называется мономером, а продукт — полимером. Молекулы полимера также называют макромолекулами.
Число мономерных звеньев в молекуле полимера называется степенью полимеризации. В формуле полимера степень полимеризации обозначают индексом «n».
Полиэтилен и полипропилен нам хорошо знакомы. Из полиэтилена изготавливают полиэтиленовую плёнку, посуду, предметы домашнего обихода и т. д. Полипропилен очень похож на полиэтилен и отличается от него только повышенной прочностью и термостойкостью. Из полипропилена изготавливают плёнку для теплиц, корпуса автомобильных аккумуляторов и многое другое. Со многими полимерами вы познакомитесь далее.
Реакции окисления
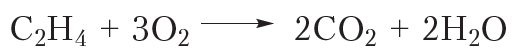
1. Горение. Взаимодействие с кислородом
Так же, как и алканы, алкены горят с образованием углекислого газа и воды:
Приведём уравнение реакции горения алкенов в общем виде:
2. Неполное окисление. Реакция с KMnO4
Окисление алкенов может протекать и без разрушения углеродного скелета. Так, при пропускании этилена через разбавленный водный раствор перманганата калия (KMnO4) фиолетового цвета окраска исчезает. Перманганат калия расщепляет π-связь в молекуле этилена, при этом σ-связь между атомами углерода сохраняется. Протекание этой реакции отобразим не с помощью уравнения, а упрощённо в виде схемы. Схема реакции окисления этилена водным раствором перманганата калия выглядит следующим образом:
Из схемы видно, что π-связь в ходе данной реакции раскрывается, к атомам углерода присоединяются две кислородсодержащие группы — OH , то есть этилен окисляется. В результате образуется этиленгликоль, представитель многоатомных спиртов.
Написание схем часто оказывается более удобным, чем уравнений, поэтому их широко используют в органической химии.
Так же, как и реакция с бромной водой, реакция с раствором перманганата калия является качественной реакцией на двойную связь. В результате данной реакции наблюдается обесцвечивание фиолетового раствора перманганата калия.
Характерными для алкенов являются реакции присоединения по двойной связи. При этом происходит расщепление π -связи. Алкены могут присоединять галогены, водород, галогеноводороды, воду.
Реакция полимеризации — это многократно повторяющаяся реакция присоединения. В результате этой реакции образуются гигантские молекулы полимеров, широко применяемых в нашей жизни.
Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; число мономерных звеньев в макромолекуле полимера называется степенью полимеризации.
Реакции обесцвечивания бромной воды и раствора перманганата калия являются качественными реакциями на двойную связь.
Вопросы и задания
1. Напишите уравнения реакций присоединения к этилену и пропилену: а) водорода; б) хлора. Назовите продукты реакций. Как на практике можно различить метан и этилен?
2. Напишите уравнение реакции бромоводорода с бутеном-2 . Назовите продукт реакции.
3. К бромной воде добавили избыток раствора гексена-1 в гептане. Какие явления будут наблюдаться при этом? Напишите уравнение протекающей реакции.
4. Напишите схему реакции взаимодействия пропилена с водным раствором перманганата калия.
5. В результате полимеризации этилена получен полимер массой 140 г, содержащий 1,505 ∙ 10 22 макромолекул. Вычислите: а) среднюю молярную массу полимера; б) степень полимеризации.
6. После пропускания через склянку с бромной водой (избыток) 20 дм 3 (н. у.) смеси этана и этилена масса склянки увеличилась на 20 г. Определите объём (н. у.) этана в смеси газов.
7*. Напишите схемы реакций, с помощью которых можно получить 2,2,3,3-тетраметилбутан из 2-метилбутена .

Источник