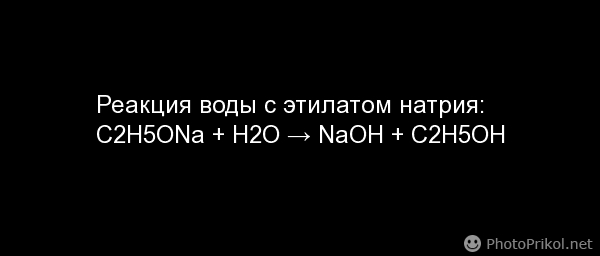Этилат натрия
| Этилат натрия | |
|---|---|
 | |
| Систематическое наименование | Этилат натрия |
| Традиционные названия | Этоксид натрия |
| Хим. формула | NaC2H5O |
| Рац. формула | CH3CH2ONa |
| Состояние | бесцветные или желтоватые кристаллы |
| Молярная масса | 68,05 г/моль |
| Температура | |
| • плавления | 260; 320 °C |
| • разложения | 260 °C |
| Растворимость | |
| • в этаноле | 28 г/100 мл |
| Рег. номер CAS | 141-52-6 |
| PubChem | 2723922 |
| Рег. номер EINECS | 205-487-5 |
| SMILES | |
| ChEBI | 52096 |
| ChemSpider | 8516 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Этилат натрия — химическое соединение, натрия и этилового спирта с формулой C2H5ONa, бесцветные или желтоватые кристаллы, реагирует с водой.
Содержание
Получение
- Растворение металлического натрия в абсолютном этиловом спирте:
2 Na + 2C2H5OH → 2C2H5ONa + H2↑
- отгонка воды из раствора NaOH в безводном этаноле в виде тройного азеотропа этанол-вода-растворитель (бензол, циклогексан, изооктан и т. д.):
C2H5OH + NaOH=C2H5ONa+H2O
Физические свойства
Этилат натрия образует бесцветные или желтоватые кристаллы.
Растворяется в этаноле. С этиловым спиртом образует аддукт вида C2H5ONa•2C2H5OH.
Источник
Почему вода разлагает этилат натрия?
Взаимодействие этилата натрия с водой записывается так:
СН3-СН2-О-Na + Н-О-Н ——> СН3-СН2-О-H + Na-О-Н.
Если записать в ионном виде, то будет так:
СН3-СН2-О(-) + Na(+) + Н-О-Н ——> СН3-СН2-О-H + Na(+) + Н-О(-).
Из обеих частей убираем ион натрия, он не принимает участия в реакции:
СН3-СН2-О(-) + Н-О-Н ——> СН3-СН2-О-H + Н-О(-).
Реакция свелась к тому, что этилат-анион «оторвал» протон от молекулы воды.
Можно трактовать и иначе: будучи более сильной кислотой, чем этанол, вода передает свой протон этилат-аниону, при этом сама превращается в гидроксид-анион.
Таким образом, это самая обычная кислотно-основная реакция: более сильная кислота (вода) вытесняет более слабую кислоту (этанол) из ее соли (этилат натрия можно и нужно рассматривать как соль).
Остался вопрос, почему вода — более сильная кислота, чем этанол. В органической химии есть такое понятие, как индуктивный эффект. Молекула этанола отличается от молекулы воды тем, что один атом водорода заменен этильной группой. Этильная группа — обладает положительным индуктивным эффектом, по сравнению с атомом водорода, т.е. слабее оттягивает на себя общую электронную пару, связывающую ее с атомом кислорода. Поэтому на атоме кислорода электронная плотность больше, чем в случае молекулы воды. И соответственно, этанол сильнее удерживает свой протон, чем вода.
Этилат натрия получается после взаимодействия Натрия и Этилового спирта.
При последующей реакции с водой, когда желтый кристаллик этилата натрия закидывают в H2O, вещество растворяется:
Вместо него остается спирт и соль NaOH.
Реакция случается из-за притяжения ионов с противоположными знаками: Натрия и группы OH.
В советское время в прессе часто встречались критические материалы примерно такого содержания «Я конечно этот роман не читал, но со всей ответственностью заявляю, что автор неправ. » и т.п. Так вот, я тоже, диссертацию Менделеева, посвящённую исследованию свойств водно-спиртовых смесей (каких именно не знаю), не читал, но со всей ответственностью заявляю, что к водке вообще, и в частности к тому, что за стандарт водки принято 40 процентное содержание (по объёму) спирта, Менделеев никакого отношения не имеет.
Вот примерно так. А тем, кто не верит, рекомендую ознакомиться непосредственно с диссертацией Дмитрия Ивановича.
Потому что соль выводит из воды кислород. Именно он так сильно бурлит, а потом перестает, потому что уже весь испарился. Даже рекомендуется при варке овощей и мяса воду сначала слегка присолить, чтобы удалить из неё кислород, который убивает полезные вещества.
Вода на Земле находится в трех агрегатных состояниях, а главное — происходит постоянный переход воды из одного состояния в другое. Именно это и является самым главным свойством Земли как планеты, которое способствовало сначала формированию постоянной географической оболочки, потом появлению жизни, потом биосферы, потом ноосферы. Постоянный переход воды из одного состояния в другое позволил растениям освоить фотосинтез, а всем организмам планеты — дыхание. Оба процесса основаны на переходе жидкой воды в газообразную и обратно. По причине постоянного перехода воды из одного состояния в другое существуют гидросфера и атмосфера как постоянные структуры планеты, а твердая вода выполняет функции буфера в этом жизнеутверждающем переходе из одного состояния в другое.
Растворимость газов в воде зависит от давления этого газа над раствором (закон Генри) и от температуры.
Первая возможность — зависимость от парциального давления данного газа. То есть если в газовой фазе над раствором не будет воздуха (или только кислорода), то и в растворе (в данном случае в воде) кислорода не останется. Так химики удаляют из растворов растворенный воздух (кислород может мешать своим окислительным действием или своим парамагнетизмом). Для этого замораживают раствор, откачивают над ним газ (воздух) до очень низкого давления и размораживают. При этом газ бурно выходит из раствора (раствор как будто кипит). После трехкратного повторения такого цикла растворенного воздуха в растворе практически нет.
Вторая возможность. Раствор через капилляр продувают минут 10 — 15 чистым азотом или аргоном, в котором нет кислорода.
Третья возможность — зависимость от температуры раствора. Это самый простой способ. Чем выше температура, тем меньше кислорода в воде, поэтому некоторые рыбы любят холодную воду, а в теплой жить не могут (замор). При 20°С в 1 л воды растворяется 9 мг кислорода (при 0°С — 14,5 мг), при 60°С растворимость кислорода падает до 5 мг/л, при 80°С — до 3 мг/л, а при 100°С в воде кислорода не остается. После охлаждения кислород из воздуха начнет медленно растворяться в воде — зависит от условий хранения воды.
Поскорей переубедите Вашего ребёнка. Вода не состоит из двух газов кислорода и водорода. Если просто смешать кислород и водород, то получится смесь газов, но она останется газом и будет пребывать в таком состоянии хоть тысячу лет, до тех пор, пока Вы её не подожжёте (т.е. каким-либо образом нагреете даже самый минимальный объём до температуры 510°С или выше.). Для этого достаточно пламени спички, или даже искры хоть от электричества, хоть от удара металлом по камню или металлу.
От того, что между двумя газами происходит химическая реакция, продукт реакции не становится жидкостью. Например, если водород прореагирует с хлором или азотом (это тоже газы) то продукты реакции (соответственно хлористый водород или аммиак) всё равно будут газами. Более того, если газ водород прореагирует с жидкостью (с бромом) или даже с твёрдыми веществами (иодом, астатом), то продукты реакции и в этом случае будут газообразными.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |