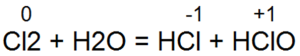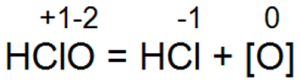- Взаимодействие галогенов с веществами
- Галогены с водой
- Галогены
- Галогены
- Химические свойства
- Взаимодействие с водой
- Взаимодействие с неметаллами
- Взаимодействие с металлами
- Взаимодействие со щелочами
- Взаимодействие с кислотами
- Взаимодействие с солями
- Взаимодействие с оксидами
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
Взаимодействие галогенов с веществами

При взаимодействии свободных галогенов со сложными веществами они также ведут себя как окислители, например при взаимодействии с водой. Вначале галоген растворяется в воде с образованием соответственно хлорной, бромной или йодной воды (Cl2aq, Br2aq или I2aq), а затем постепенно между водой и галогеном начинается реакция;
Галогены с водой
Взаимодействие хлора с водой выражается конечным уравнением
Сl2 + H2O = 2НСl + [О]
Однако эта реакция не сразу протекает до образования конечных продуктов. На первой стадии процесса образуются две кислоты — соляная НСl и хлорноватистая НСlO:
Затем происходит разложение хлорноватистой кислоты:
Образованием атомарного кислорода объясняют в значительной мере окисляющее действие хлора, которое он оказывает на микроорганизмы, находящиеся в воде, вследствие чего они погибают. Выделение атомарного кислорода объясняет также отбеливающее действие хлора, которое он оказывает на предварительно увлажненные органические вещества. Органические красители, помещенные в хлорную воду, обесцвечиваются. Лакмус, который при наличии соляной кислоты должен окрашиваться в розовый цвет, в хлорной воде, где в небольших количествах присутствует соляная кислота, не приобретает характерной для него в кислоте окраски, а полностью теряет ее. Это объясняется наличием атомарного кислорода, который оказывает на лакмус окисляющее действие.
Аналогично реагируют с водой и другие галогены: бром и иод — более медленно, фтор — значительно быстрее и энергичнее.
Пары воды горят во фторе, а стадии образования кислородной кислоты у фтора нет, либо такая кислота не существует.
Галогены реагируют и с органическими веществами. Например, если внести в атмосферу хлора бумажку, смоченную скипидаром (органическое вещество, состоящее из водорода и углерода), то можно заметить выделение большого количества сажи и ощутить запах хлористого водорода. Иногда скипидар даже самовоспламеняется в хлоре. Хлор вытесняет углерод из соединения с водородом и образует хлористый водород, а углерод выделяется в виде сажи в свободном состоянии.
Все галогены энергично взаимодействуют с каучуком и резиной. По этой причине при работе с галогенами стараются не использовать в приборах резиновых деталей.
Среди реакций с органическими веществами важно от-метить реакцию иода с крахмалом, который синеет при наличии в растворе даже незначительного количества свободного иода. Реакция очень чувствительная и является качественной реакцией на иод.
Особый интерес представляют окислительно-восстановительные реакции галогенов, происходящие между свободным галогеном и солью другого галогена. Например, если взять раствор какого-либо бромида и смешать с хлорной водой, то бесцветный раствор мгновенно окрашивается в желтый цвет. При взбалтывании с бензолом характерная окраска бензольного кольца указывает на наличие свободного брома. Это объясняется тем, что хлор как более активный галоген окисляет бром, вытесняя его из соли по уравнению:
2КВr + Cl2 = 2КСl + Вr2
Естественно, что свободный галоген должен обладать большей окислительной активностью, чем галоген, входящий в состав соли поэтому возможны реакции между иодидом и бромом, иодидом и хлором, бромидом и хлором.
Некоторые из этих реакций находят применение в технике. Например, наиболее дешевым способом получения брома является вытеснение его хлором из солей, часто из бромида магния:
MgBr2 + Сl2 = MgCl2 + Вr2
■ 17. Докажите, составив электронный баланс, что взаимодействие галогенов с водой и с солями других галогенов является окислительно-восстановительными реакциями, и объясните, почему хлорная вода обладает обеззараживающим действием. (См. Ответ)
Окислительное действие галогенов проявляется и при реакциях с другими сложными веществами. Например, если через бромную воду пропускать сероводород, то очень скоро бромная вода обесцветится и образовавшаяся жидкость помутнеет вследствие восстановления Вr0 до Вr -1 и окисления S -2 до S 0 .
Иод довольно легко окисляет серу в степени окисления +4, например в Na2SO3, до S +6 . Схема реакции:
Na2SO3 + I2 → Na2SO4 + HI
■ 18. Составьте уравнения окислительно-восстановительных реакций между бромом и сероводородом, а также между иодом и сульфитом натрия. (См. Ответ)
19. Составьте и заполните таблицу:
Источник
Галогены
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 5 :
- F — 2s 2 2p 5
- Cl — 3s 2 3p 5
- Br — 4s 2 4p 5
- I — 5s 2 5p 5
- At — 6s 2 6p 5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит
Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
- Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Реакции с неметаллами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F — )
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br — )
Реакции с водой
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Реакции с щелочами
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Галогены
Галогены — это элементы седьмой группы главной подгруппы таблицы Менделеева.
Фтор, хлор, бром, йод, астат.
Низшая степень окисления галогенов -1, высшая + 7. Фтор проявляет во всех своих соединениях степень окисления -1, так как самый электроотрицательный.
Химические свойства
Галогены — очень активные неметаллы. Самый активный — фтор, активность уменьшается вниз по группе.
Взаимодействие с водой
Хлор и бром реагирует с водой по типу диспропорционирования.
Не помнишь кислоты? смотри тут !:)
Йод в связи с малой активностью с водой практически не реагирует.
Фтор реагирует с водой иначе, так как фтор проявляет в своих соединениях только одну степень окисления -1.
На ЕГЭ и ОГЭ Вам не придется писать реакцию фтора с кислородом, однако для тестовых вопросов Вы должны о ней знать.
Взаимодействие с неметаллами
Взаимодействие с кислородом
Галогены не реагируют с кислородом, кроме фтора.
Фтор реагирует с кислородом, но образуется не оксид, а фторид, так как фтор обладает большей электроотрицательностью.
Взаимодействие с серой
Фтор реагирует с серой при комнатной температуре с образованием гексафторида серы.
Гексафторид серы понижает тембр голоса 🙂
Хлор и бром реагирует с серой с образованием соединений содержащих связь
Взаимодействие с галогенами
Галогены реагируют друг с другом 😉
Кто более электроотрицателен, тот и будет в степени окисления-1.
Взаимодействие с фосфором
Галогены реагируют с фосфором образуя галогениды фосфора (III) и фосфора (V).
Образовавшиеся галогениды используют в органическом синтезе для получения галогенпроизводных.
Взаимодействие с водородом
Фтор реагирует с водородом со взрывом даже при очень низкой температуре.
При взаимодействии галогенов с водородом образуются газообразные соединения, если их пропустить через воду, то получатся растворы кислот: плавиковой (HF), соляной (HCl), бромоводородной (HBr), йодоводородной (HI).
Плавиковая кислота является слабой, остальные кислоты — сильными, сила кислот возрастает к йодоводородной.
Взаимодействие с металлами
Галогены бурно реагируют с металлами.
Для ЕГЭ необходимо запомнить несколько моментов:
С железом фтор, хлор и бром реагируют с образованием соединений железа в валентности III.
Но с йодом образуется иодид железа (II).
Для меди ситуация похожа. С медью фтор, хлор и бром реагируют с образованием соединений меди в валентности II.
Но с йодом образуется иодид меди (I).
Взаимодействие со щелочами
Галогены (кроме фтора) вступают в реакцию диспропорционирования со щелочами.
МЕГА ВАЖНО ЗАПОМНИТЬ ДЛЯ ЭКЗАМЕНА!
С холодным и горячим раствором щелочи реакция идет по разному!
Фтор реагирует со щелочами, но не диспропорционирует.
Взаимодействие с кислотами
Галогены не реагирует с кислотами, однако йод вступает в окислительно-восстановительную реакцию с азотной кислотой.
Взаимодействие с солями
Галогены способны заместить своих собратьев (более активный галоген замещает менее активный; активность увеличивается вверх по группе )
Также галогены способны заместить серу из сульфидов.
Галогены реагируют с галогенидами металлов, если металл может повысить свою степень окисления.
Взаимодействие с оксидами
Галогены могут реагировать с некоторыми оксидами, например:
Фосген использовался в Первую мировую войну как боевое отравляющее вещество.Обладает удушающим действием. Смертельная концентрация 0,01 — 0,03 мг/л (15 минут). Антидота не существует. Защита от фосгена — противогаз.
Взаимодействие с аммиаком
Хлор реагирует с аммиаком следующим образом:
Эту реакцию нужно запомнить для экзамена.
А вот йод образует более интересное соединение — нитрид йода (III), для ЕГЭ эту реакцию знать не нужно, но круто же!
Взаимодействие с органическими веществами
Галогены широко используются в органическом синтезе.
Реакции галогенирования делятся на два типа: замещения и присоединения. Ниже перечислены реакции, которые необходимо знать для ЕГЭ.
Замещение характерно для алканов, устойчивых циклоалканов, алкенов (при нагревании, реакция Львова), бензола (в присутствии катализатора),гомологов бензола (на свету, в присутствии катализатора), предельных карбоновых кислот (в присутствии красного фосфора), фенола, анилина.
Присоединение характерно для алкенов, алкинов, алкадиенов, неустойчивых циклоалканов, циклоалкенов, бензола (на свету), стирола.
Реакцию с бромной водой используют для идентификации непредельных органических веществ (кроме аренов), фенола и анилина. Непредельные органические вещества обесцвечивают бромную воду, а фенол и анилин образуют с бромной водой осадок белого цвета.
Источник