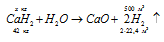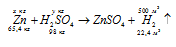- Гидрид кальция: способы получения и химические свойства
- Способ получения
- Химические свойства
- Гидриды металлов, получение и свойства
- Реакция кальция с водой
- Реакция взаимодействия кальция с водой.
- Уравнение реакции взаимодействия кальция с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Гидрид кальция — Calcium hydride
- Содержание
- Подготовка
- Использует
- Восстановление оксидов металлов
- Источник водорода
- Осушитель
- История
Гидрид кальция: способы получения и химические свойства
Гидрид кальция CaH2 — неорганическое бинарное соединение щелочноземельного металла кальция и водорода. Белый, плавится без разложения в атмосфере H2, при дальнейшем нагревании разлагается. Сильный восстановитель.
Относительная молекулярная масса Mr = 42,09 относительная плотность для тв. и ж. состояния d = 1,9; tпл ≈ 1000º C.
Способ получения
1. Гидрид кальция получают реакцией взаимодействия кальция и водорода при 500 — 700º C:
2. Хлорид кальция взаимодействует с водородом при 600 — 700º С и образует гидрат кальция и хлороводородную кислоту:
Химические свойства
1. Гидрид кальция — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. При взаимодействии с кислородом при температуре 300 — 400º C гидрид кальция образует оксид кальция и воду:
1.2. При температуре выше 1000º C г идрид кальция взаимодействует с азотом , образуя нитрид кальция и водород:
2. Гидрид кальция взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид кальция образует гидроксид кальция и газ водород:
2.2. Гидрид кальция вступает в реакцию с кислотами :
2.2.1. С разбавленной хлороводородной кислотой гидрид кальция реагирует с образованием хлорида кальция и газа водорода:
2.2.2. В результате реакции между гидридом кальция и сероводородной кислотой при 500 — 600º С образуется сульфид кальция и водород:
2.3. Гидрид кальция реагирует с газом аммиаком при t = 300º C с образованием амида кальция и водорода:
2.4. Гидрид кальция вступает во взаимодействие с солями :
В результате реакции между гидридом кальция и хлоратом калия при 450 — 550º С образуется хлорид калия, оксид кальция и вода:
3CaH2 + 2KClO3 = 2KCl + 3CaO + 3H2O
3. Гидрид кальция разлагается при температуре выше 1000º C, с образованием кальция и водорода:
Источник
Гидриды металлов, получение и свойства
Задача 794.
Как получают гидриды металлов? Составить уравнения реакций: а) получения гидрида кальция; б) взаимодействия его с водой.
Решение:
Соединения водорода с металлами называют гидридами. Гидриды металлов получают при нагревании металла в струе водорода. Гидриды имеют ионное строение, так металл кальций входит в состав СаН2 в виде иона Са 2+ , а водород – в виде аниона Н — . Таким образом, можно сделать вывод, что гидриды – солеподобные соединения.
а) При нагревании в струе водорода металлический кальций соединяется с водородом, образуя гидрид кальция:
б) Гидрид кальция СаН2 – солеподобное вещество белого цвета, которое гидролизуется как соль сильного основания и слабой кислоты по аниону:
Эта реакция может служить удобным методом для получения водорода в лабораторных условиях. Гидрид кальция можно использовать в качестве эффетивного осушителя воздушных, газовых и жидких неводных смесей, а также для количественного определения содержания воды в органических соединениях и кристаллогидратах и т.д. СаН2 служит для обнаружения следов воды.
Задача 795.
Для наполнения аэростатов в полевых условиях иногда пользуются взаимодействием гидрида кальция с водой. Сколько килограммов СаН2 придется израсходовать для наполнения аэростата объемом 500 м 3 (считая условия нормальными)? Сколько потребуется для этой цели цинка и серной кислоты?
Решение:
а) Уравнение реакции имеет вид:
Молекулярная масса СаН2 равна 42 а. е. м., значит, СаН2 – 42кг/кмоль. Массу СаН2 находим из пропорции:
х : 500 = 42 : 44,8; х = (42 . 500)/44,8 = 468,75кг.
б) Уравнение реакции имеет вид:
Массу цинка находим из пропорции:
х : 500 = 65,4 : 22,4; х = (65,4 . 500)/22,4 = 1459,82кг.
Массу серной кислоты находим из пропорции:
у : 500 = 98 : 22,4; х = (98 . 500)/22,4 = 2187,50кг.
Ответ: m(CaH2) = 468,75кг, m(Zn) = 1459,82кг, m(H2SO4) = 2187,50кг.
Задача 796.
Почему водород и кислород не взаимодействуют при обычной температуре, а при 700 °С реакция протекает практически мгновенно?
Решение:
Атомы водорода в молекуле Н2 и атомы кислорода в молекуле О2 соединены между собой очень прочными ковалентными связями. Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции. Поэтому любое столкновение между молекулами Н2 и О2 при обычной температуре и атмосферном давлении оказывается неэффективным. И только при повышении температуры, когда кинетическая энергия сталкивающихся молекул Н2 и О2 делается большой, некоторые соударения молекул Н2 и О2 становятся эффективными и приводят к образованию активных центров, что даёт начало реакции взаимодействия водорода с кислородом, т. е. реакция инициируется, и скорость её резко возрастает. При смешивании водорода и кислорода в отношении 2 : 1 можно получить взрыв, если инициировать реакции, например ударом. При 300 °С в смеси Н2 и О2 через несколько дней образуется немного Н2О, а при 500 0 С водород полностью соединяется с кислородом за несколько часов, при нагревании смеси до 700 0 С происходит быстрый подъём температуры и реакция заканчивается со взрывом. Поэтому чтобы взорвать смесь Н2 и О2 нужно подогреть её до 700 °С хотя бы в одном месте.
Источник
Реакция кальция с водой
Реакция взаимодействия кальция с водой.
Уравнение реакции взаимодействия кальция с водой:
Кальций взаимодействует с водой.
В зависимости от температурного режима, избытка или недостатка воды реакция кальция с водой протекает по-разному.
2Ca + H2O → CaO + CaH2 (t = 200-300 °C).
Первая реакция протекает при обычных условиях и избытке воды , вторая – при условии: при температуре 200-300 °C и недостатке воды .
В результате первой реакции кальция с водой образуются гидроксид кальция и водород , в результате второй реакции кальция с водой образуются оксид кальция и гидрид кальция .
В ходе первой реакции кальция с водой при стандартных условиях выделяется тепловая энергия (теплота).
Таким образом, первая реакция кальция с водой носит экзотермический характер.
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 485)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 492)
- Метан, получение, свойства, химические реакции (23 734)
- Этилен (этен), получение, свойства, химические реакции (22 819)
- Природный газ, свойства, химический состав, добыча и применение (21 169)
- Крахмал, свойства, получение и применение (20 575)
- Целлюлоза, свойства, получение и применение (19 425)
- Пропилен (пропен), получение, свойства, химические реакции (19 106)
- Прямоугольный треугольник, свойства, признаки и формулы (18 729)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Гидрид кальция — Calcium hydride
- 7789-78-8
Y
- 94784
Y
- WY779SQ0XW
Y




 Y проверить ( что есть ?)
Y проверить ( что есть ?)  Y
Y  N
NГидрид кальция представляет собой химическое соединение с формулой CaH 2 и, следовательно, является гидридом щелочноземельного металла . Этот серый порошок (белый, если чистый, что бывает редко) бурно реагирует с водой с выделением газообразного водорода . Таким образом, CaH 2 используется как осушающий агент, то есть осушитель .
CaH 2 представляет собой солевой гидрид, что означает, что его структура подобна соли. Все щелочные и щелочно-земельные металлы тяжелее бериллия образуют солевые гидриды. Хорошо известным примером является гидрид натрия , который кристаллизуется в мотиве NaCl. Эти вещества нерастворимы во всех растворителях, с которыми они не реагируют. СаН 2 кристаллизуется в PbCl 2 ( cotunnite ) структуры .
Содержание
Подготовка
Гидрид кальция получают из его элементов прямым соединением кальция и водорода при температуре от 300 до 400 ° C.
Использует
Восстановление оксидов металлов
CaH 2 представляет собой восстановитель для производства металла из оксидов металлов Ti, V, Nb, Ta и U. Предлагается действовать через его разложение до металлического Ca:
TiO 2 + 2 CaH 2 → Ti + 2 CaO + 2 H 2
Источник водорода
CaH 2 использовался для производства водорода. В 1940-х годах он был доступен под торговым названием «Hydrolith» как источник водорода:
«Торговое название этого соединения -« гидролит »; в экстренных случаях может использоваться как переносной источник водорода, для заправки дирижаблей. Для такого использования это довольно дорого ».
Ссылка на «чрезвычайную ситуацию», вероятно, относится к использованию в военное время. Однако этот состав на протяжении десятилетий широко использовался в качестве безопасного и удобного средства для надувания метеозондов. Точно так же его регулярно используют в лабораториях для производства небольших количеств водорода высокой степени чистоты для экспериментов. Влагосодержание дизельного топлива оценивается по водороду, выделяющемуся при обработке CaH 2 .
Осушитель
Реакцию CaH 2 с водой можно представить следующим образом:
Два продукта гидролиза, газообразный H 2 и Ca (OH) 2 , легко отделяются от высушенного растворителя.
Гидрид кальция является относительно мягким осушителем и, по сравнению с молекулярными ситами , вероятно, неэффективен. Его использование является более безопасным , чем более реакционноспособные вещества , такие как натрий металла или сплава натрия-калия . Гидрид кальция широко используется в качестве осушителя для основных растворителей , таких как амины и пиридин . Он также используется для сушки спиртов.
Несмотря на удобство, CaH 2 имеет несколько недостатков:
- Он нерастворим во всех растворителях, с которыми он не реагирует активно, в отличие от LiAlH 4 , поэтому скорость его высыхания может быть медленной.
- Поскольку CaH 2 и Ca (OH) 2 почти неотличимы по внешнему виду, качество образца CaH 2 не очевидно визуально.
История
Во время битвы за Атлантику немецкие подводные лодки использовали гидрид кальция в качестве приманки для гидролокатора, названной « Смелым» .
Источник