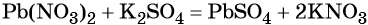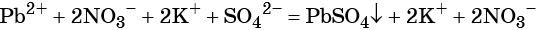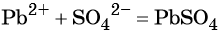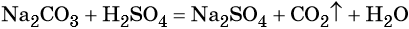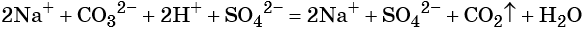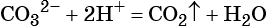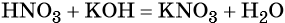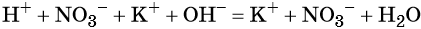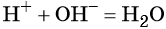Калий: способы получения и химические свойства
Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
Способ получения
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Качественная реакция
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет .
Химические свойства
1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия :
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K 0 + 2 H2 O = 2 K + OH + H2 0
2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород :
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода:
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Калий может взаимодействовать с гидроксидами:
Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Источник
Реакции ионного обмена и условия их осуществления
Реакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов.
Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращённой ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой). При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме.
Уравнения реакций обмена в водных растворах электролитов составляют так.
- Записывают в левой части уравнения все формулы веществ, вступивших в реакцию, в молекулярной или ионной форме.
- Руководствуясь знаниями физико-химических свойств реагентов и таблицами растворимости веществ, составляют формулы продуктов реакции.
- Проверяют число атомов каждого элемента в обеих частях уравнения и определяют необходимые стехиометрические коэффициенты перед формулами.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциированные соединения) и комплексные ионы.
Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит.
Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращённой ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме.
Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 3. Реакция между азотной кислотой и едким калием. В результате данной реакции образуется малодиссоциированное соединение — вода и в растворе остаются катионы калия и нитрат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Тренировочные задания
1. Осадок образуется при взаимодействии водных растворов
2. Газ выделяется при взаимодействии водных растворов
3. Краткое ионное уравнение H + + OH – = H2O описывает взаимодействие
1) гидроксида кальция и фосфорной кислоты
2) гидроксида лития и фосфорной кислоты
3) гидроксида натрия и бромоводородной кислоты
4) гидроксида алюминия и бромоводородной кислоты
4. Краткое ионное уравнение 3Ba 2+ + 2PO4 3– = Ba3(PO4)2↓ описывает взаимодействие
1) карбоната бария и фосфорной кислоты
2) карбоната бария и фосфата натрия
3) хлорида бария и фосфорной кислоты
4) хлорида бария и фосфата натрия
5. Краткое ионное уравнение Ba 2+ + SO4 2– = BaSO4↓ описывает взаимодействие
1) хлорида бария и сульфата натрия
2) хлорида бария и сернистой кислоты
3) гидроксида бария и сульфата натрия
4) гидроксида бария и серной кислоты
6. Краткое ионное уравнение Ag + + Cl – = AgCl↓ описывает взаимодействие
1) хлорида кальция и бромида серебра
2) фосфата серебра и соляной кислоты
3) карбоната серебра и хлорида натрия
4) нитрата серебра и хлорида калия
7. Краткое ионное уравнение H + + OH – = H2O отвечает взаимодействию
1) азотной кислоты и гидроксида железа (III)
2) бромоводородной кислоты и гидроксида натрия
3) азотной кислоты и гидроксида меди
4) сернистой кислоты и гидроксида кальция
8. Краткое ионное уравнение 2Н + + S 2– = Н2S↑ отвечает взаимодействию
1) соляной кислоты и сульфида железа (II)
2) сернистой кислоты и сульфида калия
3) азотной кислоты и сульфида меди
4) азотной кислоты и сульфида натрия
9. Краткое ионное уравнение 2Н + + CO3 2– = CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната бария
3) азотной кислоты и карбоната калия
4) серной кислоты и карбоната бария
10. Краткое ионное уравнение 2Н + + CaCO3 = Ca 2+ + CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната кальция
3) фосфорной кислоты и карбоната кальция
4) серной кислоты и карбоната кальция
11. Краткое ионное уравнение Al 3+ + 3OH – = Al(OH)3↓ отвечает взаимодействию
1) сульфата алюминия и гидроксида кальция
2) сульфата алюминия и гидроксида бария
3) сульфата алюминия и гидроксида меди
4) сульфата алюминия и гидроксида натрия
12. Краткое и полное ионное уравнения совпадают для реакции
1) соляной кислоты и карбоната калия
2) уксусной кислоты и карбоната бария
3) уксусной кислоты и гидроксида калия
4) серной кислоты и гидроксида калия
13. Одновременно в растворе не могут существовать ионы
1) Ba 2+ , Fe 2+ , PO4 3– , CO3 2–
2) Ba 2+ , NO3 – , Cl – , K +
3) CH3COO – , Li + , Br – , Al3 +
4) Mg 2+ , Br – , K + , Cl –
14. Одновременно в растворе могут существовать ионы
1) Ba 2+ , Fe 2+ , PO4 3– , SO4 2–
2) Ba 2+ , SO4 2– , Ca 2+ , PO4 3–
3) Na + , Ba 2+ , NO3 – , Cl –
4) Mg 2+ , Ca 2+ , SO3 2– , CO3 2–
15. Образование осадка происходит при взаимодействии водных растворов
16. Образование газа происходит при взаимодействии водных растворов
1) сульфата калия и хлорида бария
2) гидроксида алюминия и серной кислоты
3) хлорида кальция и карбоната натрия
4) соляной кислоты и карбоната натрия
17. С выпадением осадка протекает реакция ионного обмена между растворами
1) нитрата натрия и фторида калия
2) хлорида алюминия и избытка гидроксида калия
3) нитрата серебра и фторида натрия
4) нитрата магния и гидроксида калия
18. С выделением газа протекает реакция ионного обмена между растворами
1) карбоната калия и бромоводородной кислоты
2) сульфата натрия и гидроксидом калия
3) нитрата серебра и бромида цинка
4) нитрата алюминия и гидроксида бария
19. С выделением газа протекает реакция ионного обмена между растворами
1) гидроксида бария и азотной кислоты
2) сульфата алюминия и нитрата бария
3) нитрата серебра и йодида лития
4) азотной кислотой и карбоната аммония
20. С выделением воды протекает реакция ионного обмена между растворами
1) нитрата меди и хлорида железа
2) гидрокарбоната натрия и гидроксида натрия
3) нитрата ртути и бромида лития
4) нитрата аммония и нитрита натрия
Источник
Свойства калия и его взаимодействие с водой
Почему его нельзя хранить на открытом воздухе
Калий — девятнадцатый элемент периодической таблицы Менделеева, относится к щелочным металлам. Это простое вещество, которое при нормальных условиях пребывает в твердом агрегатном состоянии. Закипает калий при температуре 761 °С. Температура плавления элемента — 63 °С. Калий имеет серебристо-белую окраску с металлическим блеском.
Химические свойства калия
Калий — элемент, обладающий высокой химической активностью, поэтому его нельзя хранить на открытом воздухе: щелочной металл моментально вступает в реакцию с окружающими веществами. Этот химический элемент относится к I группе и IV периоду таблицы Менделеева. Калий обладает всеми характерными для металлов свойствами.
Он взаимодействует с простыми веществами, к которым относятся галогены (бром, хлор, фтор, иод) и фосфор, сера, азот и кислород. Взаимодействие калия с кислородом называется окислением. В течение этой химической реакции кислород и калий расходуются в молярном соотношении 4:1, в результате чего образуется оксид калия в количестве двух частей. Такое взаимодействие можно выразить уравнением реакции:
Во время горения калия наблюдается пламя ярко-фиолетового цвета.
Такое взаимодействие считается качественной реакцией на определение калия. Реакции калия с галогенами называются в соответствии с названиями химических элементов: это фторирование, иодирование, бромирование, хлорирование. Такие взаимодействия являются реакциями присоединения. Пример — реакция между калием и хлором, в результате которой образуется хлорид калия. Для проведения такого взаимодействия берут два моля калия и один моль хлора. В результате образуется два моля калия:
При горении на открытом воздухе калий и азот расходуются в молярном соотношении 6:1. В результате такого взаимодействия образуется нитрид калия в количестве двух частей:
Соединение представляет собой кристаллы зелено-черного цвета. С фосфором калий реагирует по такому же принципу. Если взять 3 моля калия и 1 моль фосфора, получится 1 моль фосфида:
Калий реагирует с водородом, образуя гидрид:
Все реакции присоединения происходят при высоких температурах
Взаимодействие калия со сложными веществами
К сложным веществам, с которыми вступает в реакцию калий, относятся вода, соли, кислоты и оксиды. Так как калий — активный металл, он вытесняет атомы водорода из их соединений. Пример — реакция, происходящая между калием и соляной кислотой. Для ее проведения берется по 2 моля калия и кислоты. В результате реакции образуется 2 моля хлорида калия и 1 моль водорода:
2К + 2НСІ = 2КСІ + Н₂
Более детально стоит рассмотреть процесс взаимодействия калия с водой. Калий бурно взаимодействует с водой. Он движется по поверхности воды, его подталкивает выделяющийся водород:
2K + 2H₂O = 2KOH + H₂↑
В ходе реакции в единицу времени выделяется много тепла, что приводит к воспламенению калия и выделяющегося водорода. Это очень интересный процесс: при контакте с водой калий мгновенно воспламеняется, фиолетовое пламя потрескивает и быстро передвигается по поверхности воды. В конце реакции происходит вспышка с разбрызгиванием капель горящего калия и продуктов реакции.
Основной конечный продукт реакции калия с водой — гидроксид калия (щелочь). Уравнение реакции калия с водой:
4K + 2H₂O + O₂ = 4KOH
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
При неправильном проведении эксперимента можно получить ожог щелочью. Для реакции обычно используют кристаллизатор с водой, в который помещают кусочек калия. Как только водород прекращает горение, многие хотят заглянуть в кристаллизатор. В этот момент происходит завершающая стадия реакции калия с водой, сопровождающаяся слабым взрывом и разбрызгиванием образовавшейся горячей щелочи. Поэтому в целях безопасности стоит держаться на некотором расстоянии от лабораторного стола, пока реакция не завершится полностью. Здесь вы найдете самые зрелищные опыты, которые можно проводить с детьми дома.
Строение калия
Атом калия состоит из ядра, в котором содержатся протоны и нейтроны, и электронов, вращающихся вокруг него. Количество электронов всегда равно количеству протонов, находящихся внутри ядра. При отсоединении электрона или при присоединении к атому он перестает быть нейтральным и превращается в ион. Ионы делятся на катионы и анионы. Катионы обладают положительным зарядом, анионы — отрицательным. При присоединении к атому электрона он превращается в анион; если же один из электронов покидает свою орбиту, нейтральный атом превращается в катион.
Порядковый номер калия в периодической таблице Менделеева — 19. Значит, протонов в ядре химического элемента находится тоже 19. Вывод: электронов вокруг ядра расположено 19. Количество протонов в структуре атома определяется так: от атомной массы отнять порядковый номер химического элемента. Вывод: в ядре калия находится 20 протонов. Калий принадлежит к IV периоду, имеет 4 «орбиты», на которых равномерно располагаются электроны, пребывающие в постоянном движении. На первой «орбите» расположены 2 электрона, на второй — 8; на третьей и на последней, четвертой «орбите», вращается 1 электрон. Этим объясняется высокий уровень химической активности калия: его последняя «орбита» не заполнена полностью, поэтому элемент стремится соединиться с другими атомами. В результате электроны последних орбит двух элементов станут общими.
Источник