Химические свойства металлов
Цель работы. Изучение свойств s-, p-, d-элементов-металлов (Mg, Al, Fe, Zn) и их соединений.
1. Теоретическая часть
Все металлы по своим химическим свойствам являются восстановителями, т.е. они отдают электроны при протекании химической реакции. Атомы металлов относительно легко отдают валентные электроны и переходят в положительно заряженные ионы.
1.1. Взаимодействие металлов с простыми веществами
При взаимодействии металлов с простыми веществами в качестве окислителей обычно выступают неметаллы. Металлы реагируют с неметаллами с образованием бинарных соединений.
1. При взаимодействии с кислородом металлы образуют оксиды:
2Mg + O2 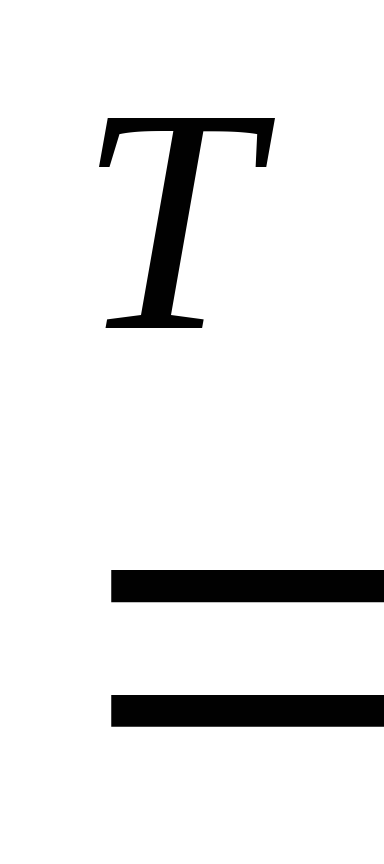
2Cu + O2 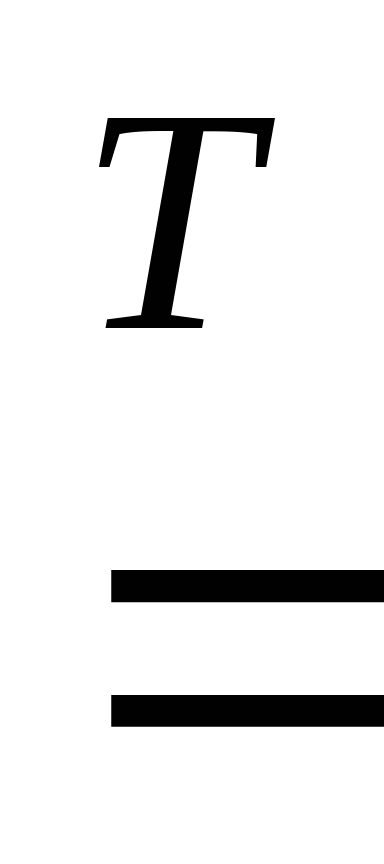
2. Металлы реагируют с галогенами (F2, Cl2, Br2, I2) с образованием солей галогеноводородных кислот:
2Fe + 3Cl2 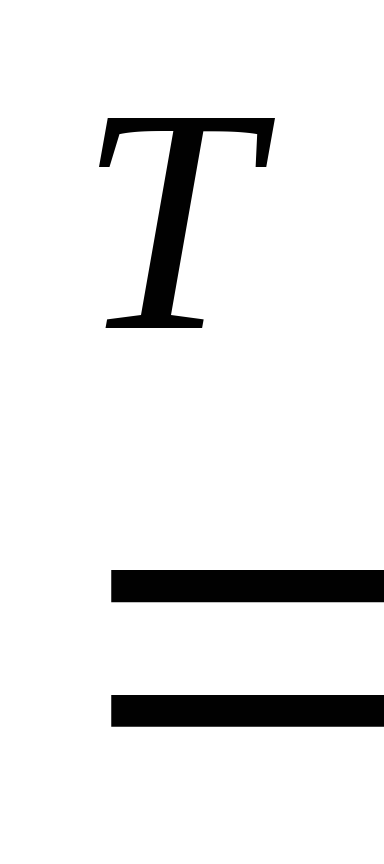
3. При взаимодействии металлов с серой образуются сульфиды (соли сероводородной кислоты H2S):
4. С водородом взаимодействуют активные металлы с образованием гидридов металлов, которые являются солеподобными веществами:
2Na + H2 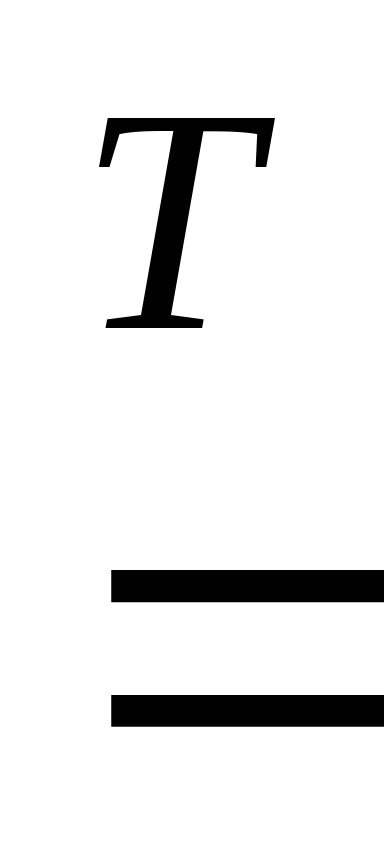
Ca + H2 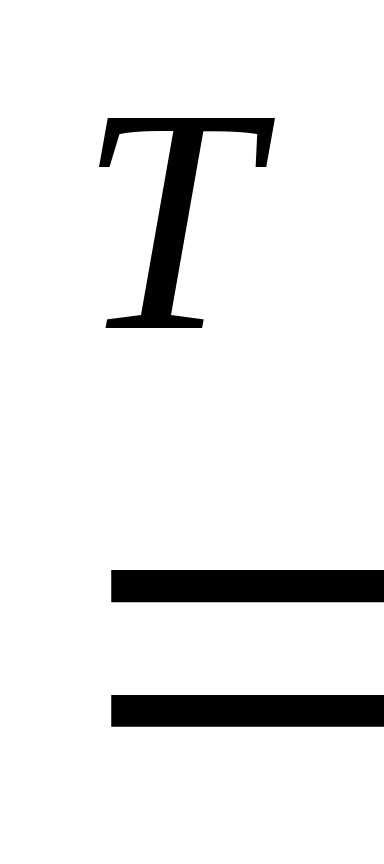
В гидридах металлов водород имеет степень окисления (-1).
Металлы могут взаимодействовать и с другими неметаллами: азотом, фосфором, кремнием, углеродом с образованием соответственно нитридов, фосфидов, силицидов, карбидов. Например:
3Mg + N2 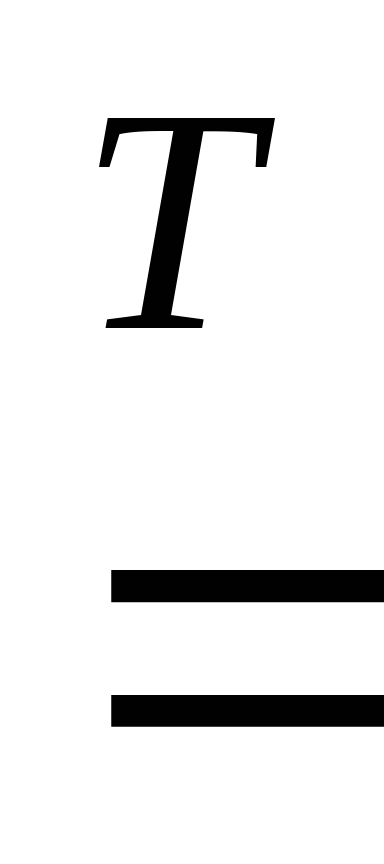
3Ca + 2P 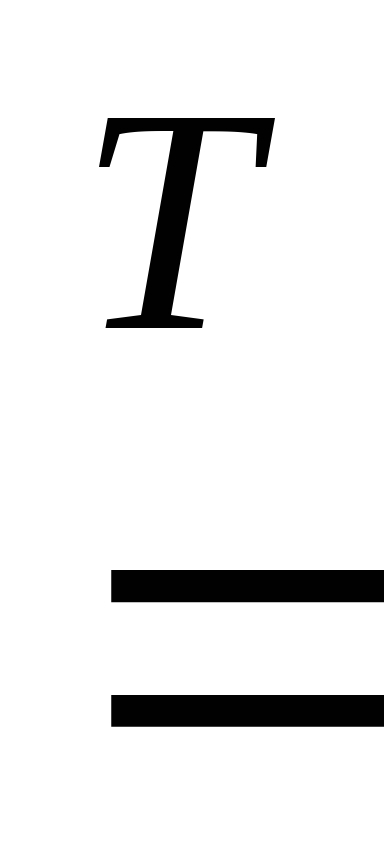
2Mg + Si 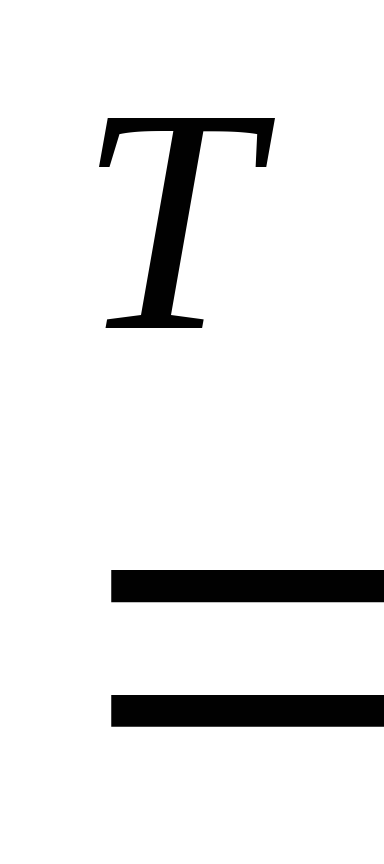
4Al + 3C 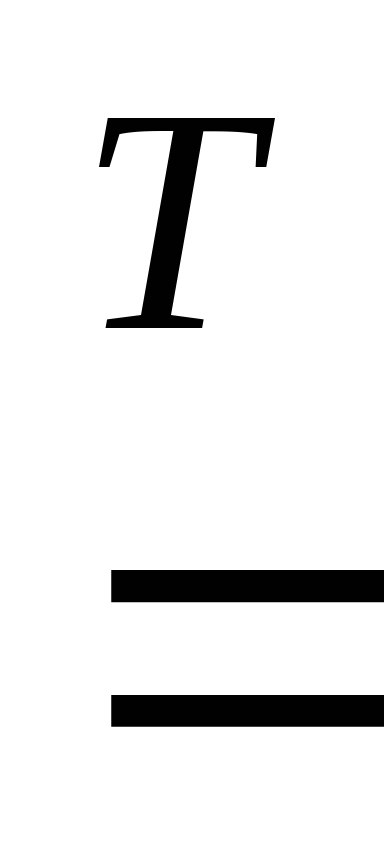
5. Металлы могут также взаимодействовать между собой с образованием интерметаллических соединений:
Интерметаллическими соединениями (или интерметаллидами) называют соединения, образуемые между собой элементами, которые относятся обычно к металлам.
1.2. Взаимодействие металлов с водой
Взаимодействие металлов с водой – это окислительно-восстановительный процесс, в котором металл является восстановителем, а вода выполняет роль окислителя. Реакция протекает по схеме:
С водой при обычных условиях взаимодействуют щелочные и щелочноземельные металлы с образованием растворимых оснований и водорода:
Магний реагирует с водой при нагревании:
Mg + 2H2O 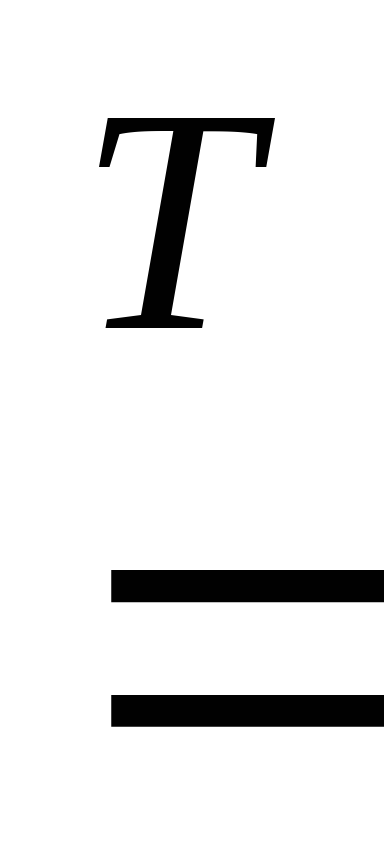
Железо и некоторые другие активные металлы взаимодействуют с горячим водяным паром:
3Fe + 4H2O 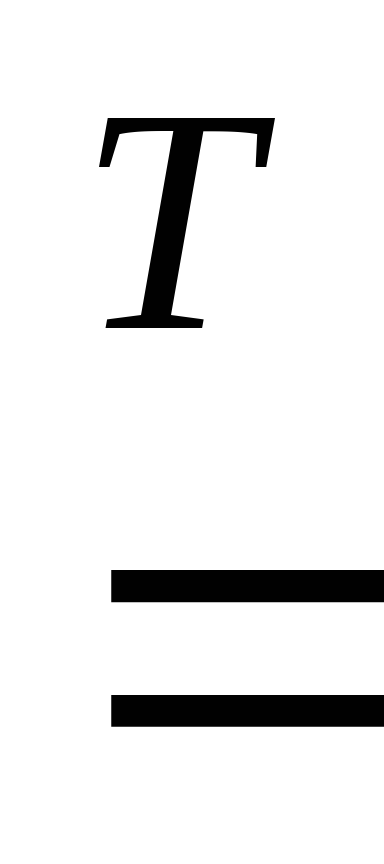
Металлы, имеющие положительные электродные потенциалы, не взаимодействуют с водой.
Не взаимодействуют с водой 4d-элементы (кроме Cd), 5d-элементы и Cu (3d-элемент).
1.3. Взаимодействие металлов с кислотами
По характеру действия на металлы наиболее распространенные кислоты можно разделить на две группы.
1. Кислоты-неокислители: хлороводородная (соляная, HCl), бромоводородная (HBr), йодоводородная (HI), фтороводородная (HF), уксусная (CH3COOH), разбавленная серная (H2SO4 (разб.)), разбавленная ортофосфорная (H3PO4 (разб.)).
2. Кислоты-окислители: азотная (HNO3) в любой концентрации, концентрированная серная (H2SO4 (конц.)), концентрированная селеновая (H2SeO4(конц.)) .
Взаимодействие металлов с кислотами-неокислителями. Окисление металлов ионами водорода H + в растворах кислот-неокислителей происходит более энергично, чем в воде.
Все металлы, имеющие отрицательное значение стандартного электродного потенциала, т.е. находящиеся в электрохимическом ряду напряжений до водорода, вытесняют водород из кислот-неокислителей. Реакция протекает по схеме:
Металлы с переменной степенью окисления (Fe, Cо, Ni и др.) образуют ионы в своей низшей степени окисления (Fe 2+ , Co 2+ , Ni 2+ и другие):
При взаимодействии некоторых металлов с кислотами-неокислителями: HCl, HF, H2SO4 (разб.), HCN образуются нерастворимые продукты, предохраняющие металл от дальнейшего окисления. Так, поверхность свинца в HCl (разб) и H2SO4(разб) пассивируется плохо растворимыми солями PbCl2 и PbSO4 соответственно.
Взаимодействие металлов с кислотами-окислителями. Серная кислота в разбавленном растворе – слабый окислитель, а в концентрированном – очень сильный. Окисляющая способность концентрированной серной кислоты H2SO4 (конц.) определяется анионом SO4 2 , окислительный потенциал которого значительно выше, чем иона H + . Концентрированная серная кислота является сильным окислителем за счёт атомов серы в степени окисления (+6). Кроме того, в концентрированном растворе H2SO4 содержится мало ионов H + , так как в концентрированном растворе она слабо ионизирована. Поэтому при взаимодействии металлов с H2SO4 (конц.) водород не выделяется.
Реагируя с металлами как окислитель, H2SO4 (конц.) переходит чаще всего в оксид серы (IV) (SO2), а при взаимодействии с сильными восстановителями – в S или H2S:
Для удобства запоминания рассмотрим электрохимический ряд напряжений, который выглядит так:
Li, Rb, K, Cs, Ba, Sr, Ca, Na, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au .
В табл. 1. представлены продукты восстановления концентрированной серной кислоты при взаимодействии с металлами различной активности.
Продукты взаимодействия металлов с концентрированной
Источник
Урок на тему «Химические свойства металлов»
Урок –лабораторная работа «Химические свойства металлов»
МБОУ «Большесундырская СОШ» Моргаушского района
Тема урока: «Химические свойства металлов»
Тип урока: урок — лабораторная работа.
Цель урока : закрепление на практике знаний о химических свойствах металлов.
1. Продолжить формирование умений наблюдать за явлениями и делать выводы.
2. Продолжить формирование умений и навыков учащихся по использованию лабораторного оборудования для проведения эксперимента.
3. Продолжить формирование умений учащихся работать в группах.
4. Продолжить формирование научного мировоззрения.
репродуктивный (повторение), наглядный, поисковый.
— предметные: знание химических свойств металлов в зависимости от их положения в ряду напряжений;
— метапредметные: умение работать с лабораторным оборудованием, с химическими веществами, умение применять теоретические знания на практике;
— личностные : развитие любознательности, формирование интереса к различным металлам и их применением.
Оборудование и материалы: медиапроектор, компьютер; лабораторное оборудование на столах учащихся — пробирки, спиртовка, держатель, спички; образцы металлов- магний, железо, медь, цинк; растворы соляной кислоты, медного купороса, вода. Демонстрационное оборудование – пробирка с водой, р-р фенолфталеина, натрий, магний, спички, спиртовка.
Основные понятия, закрепляемые на уроке: ряд напряжений металлов, общие химические свойства металлов.
1. Подготовка к закреплению материала через повторение и актуализацию опорных знаний;
2. Сообщение темы, цели, задач урока и мотивация учебной деятельности;
3. Ознакомление с техникой безопасности и этапами лабораторной работы.
4. Лабораторная работа.
5. Задание на дом;
6. Подведение итогов урока.
1. Подготовка к закреплению материала через повторение и актуализацию опорных знаний.
На экране рассказ «Платье из металла»
В начале XX века из Нью-Йоркского порта вышла в открытый океан красавица-яхта. Её владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклепками . Это было красиво-сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако через несколько дней обшивка корпуса начала расходиться, и яхта пошла быстро ко дну.
Почему яхта затонула? Что не учли конструкторы яхты? Почему необходимо знать химические свойства металлов? С чем могут реагировать металлы и изделия из них ?
Сообщение темы, цели, задач урока и мотивация учебной деятельности.
Итак, цель урока с помощью лабораторных опытов доказать, что металлы по-разному реагируют с окружающими их веществами и закрепить знания о химических свойствах металлов.
На доске учитель, с помощью ответов учеников, записывает химические свойства металлов (оставляет на доске место для химич уравнений, которые будут писать вызванные к доске ученики)
3. Ознакомление с техникой безопасности и этапами лабораторной работы.
Ученикам до начала урока раздается лабораторное оборудование, реактивы и образцы металлов.
1- техника безопасности при нагревании веществ, правила пользования со спиртовкой, правила работы с кислотами.
2- демонстрация учителем видеофрагмента взаимодействия алюминия с йодом (после этого проектор можно выключить)
3*- демонстрация учителем реакции натрия с кислородом (запись химического уравнения на доске с указанием признаков реакции)
демонстрация учителем бенгальской свечи и реакции магния с кислородом на пламени спиртовки (запись химического уравнения на доске с указанием признаков реакции);
4- демонстрация учителем реакции натрия с водой (запись химического уравнения на доске с указанием признаков реакции);
5- выполнение учащимися опыта взаимодействия меди с кислородом при нагревании ( запись химического уравнения выполняет вызванный к доске ученик);
«МИНУТКА ЗДОРОВЬЯ» — «Ребята, закройте глаза, руки положили на колени, дыхание ровное, сосчитайте до 10. Отдохнули? Приступаем к работе».
6- выполнение учащимися опыта взаимодействия магния или железа с водой при нагревании (запись химического уравнения на доске с указанием признаков реакции);
7- выполнение учащимися опыта взаимодействия цинка с соляной кислотой (запись химического уравнения на доске с указанием признаков реакции );
8* (если позволяет время) выполнение учащимися опыта взаимодействия меди с соляной кислотой .
9- выполнение учащимися опыта взаимодействия железного гвоздя с раствором медного купороса (запись химического уравнения на доске с указанием признаков реакции).
4. Первичное осмысление и закрепление знаний с помощью выполнения проверочного задания.
Вывод: химические свойства металлов зависят от их положения в ряду напряжений.
кальций надо хранить под керосином.
магний растворяется в горячей воде.
серебряные изделия легко окисляются.
никель вытесняет цинк из его соли.
металлы от лития до свинца боятся «кислотных дождей».
можно ли хранить медный купорос в железных ведрах.
5. Задание на дом.
Решить задачи 1 и 2 на странице 112 на сплавы. Прочитайте, если есть вопросы, то давайте их рассмотрим.
Источник
Конспект на тему «Химические свойства металлов.Ряд активности металлов».
Класс 9 Г Дата 12.02.21г.
Тема урока: Химические свойства металлов. Ряд активности металлов.
Цель урока: познакомить учащихся с химическими свойствами металлов, рассмотреть ряд активности (электрохимический ряд напряжений) металлов.
— рассмотреть химическую активность металлов исходя из положения в периодической таблице Д.И. Менделеева и в электрохимическом ряду напряжения металлов;
— рассмотреть химические свойства металлов.
— развивать умения составлять уравнения реакций в соответствие с химическими свойствами металлов.
— воспитывать интерес к предмету, формировать навыки поведения в коллективном и индивидуальном учебном труде.
— знать химические свойства металлов;
— уметь составлять уравнения реакций в соответствие с химическими свойствами металлов.
— формировать уважительное отношение к чужому мнению;
— формировать ответственное отношение к учению.
— уметь слушать собеседника и вести диалог; уметь признавать возможность существования различных точек зрения.
— продолжить развитие умения планировать и регулировать свою деятельность, самостоятельно планировать пути достижения цели.
— умение определять понятия, устанавливать аналогии, строить логические заключения и делать выводы.
Тип урока: урок изучения нового материала
Жил однажды дровосек, пребывавший в очень бедственном положении. Он существовал на ничтожные денежные суммы, вырученные за дрова, которые он приносил в город на себе из ближайшего леса.
Однажды мудрец, проходивший по дороге, увидел его за работой и посоветовал ему идти дальше в лес, сказав:
— Иди вперёд, иди вперёд!
Дровосек послушался совета, отправился в лес и шёл вперёд, пока не дошёл до сандалового дерева. Он был очень обрадован этой находкой, срубил дерево и, захватив с собой столько кусков его, сколько мог унести, продал их на базаре за хорошую цену. Потом он начал удивляться, почему добрый мудрец не сказал ему о том, что в лесу есть сандаловое дерево, а просто посоветовал идти вперёд. На следующий день, дойдя до срубленного дерева, он пошёл дальше и нашёл медные залежи. Он взял с собой столько меди, сколько мог унести и, продав её на базаре, выручил ещё больше денег. На следующий день он пошёл ещё дальше и нашёл серебряные россыпи. На следующий день он нашёл золото, потом — алмазы и, наконец, приобрёл огромные богатства.
Именно таково положение человека, который стремится к истинному знанию: если он не остановится в своём движении после того, как достигнет некоторых сверхъестественных сил, то, в конце концов, найдёт богатство вечного Знания и Истины.
3.Актуализация опорных знаний учащихся.
1.Блиц опрос – небольшой мозговой штурм.
1. На какие группы мы разделили элементы Периодической системы?
Ответ: Металлы и неметаллы.
2. Определите расположение металлов в ПСХЭ
Ответ: Нижний угол относительно диагонали Вор-Астат, и все элементы побочных подгрупп.
3. Какая кристаллическая решетка свойственна для металлов?
Ответ: Металлическая кристаллическая решетка
4. Чем она отличается от всех других?
Ответ: в узлах металлической кристаллической решетки располагаются атомы и положительные ионы металлов, между которыми находится свободные электроны.
5. Какие общие физические свойства металлов объясняются наличием металлическая кристаллической решети.
Ответ: электропроводность, теплопроводность, металл блеск, пластичность, легкость тугоплавкость, легкоплавкость, твердость, мягкие
6. Как называется способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность);
7. Какой металл самый легкий?
Ответ: литий (Li)
8. Назовите самый тяжелый металл?
Ответ: Осмий (Os)
9. Лучшие проводники электричества среди металлов?
Ответ: серебро и медь;
10. Назовите самый тугоплавкий металл?
Ответ: Вольфрам (W)
11. Какой металл самый легкоплавкий?
Ответ: Ртуть (Hg)
12. Назовите самый пластичный металл?
Ответ: Золото (Au)
2.Индивидуальное домашнее задание.
Учитель: «Роберт Вуд, знаменитый американский физик и великий любитель всяческих проделок, направлялся из лаборатории домой на обед. Дорога шла через негритянский квартал. Была зимняя оттепель, и огромная лужа распростерлась по мостовой между тротуарами, на которых толпились негры, вышедшие погреться на солнышке. Проходя мимо них, Вуд громко закашлял и на виду у всех плюнул в лужу, незаметно бросив в том же направлении кусок натрия величиной с грецкий орех. Прогремел взрыв, полетели искры, и большое желтое пламя поднялось над поверхностью воды. Затем раздались вопли, молитвы и один голос громче, чем все остальные вместе взятые, пробасил: «спасайся, кто может, негры! Этот человек плюнул огнем! На вид он молодой, но только сам старый дьявол, сам старый сатана умеет это делать!» О каких свойствах натрия идет речь в этом отрывке?
Ученик: О химических
Учитель: Следовательно, тема нашего урока «Характерные химические свойства металлов».
4. Изложение нового материала.
Учитель : Мир вокруг нас – это совокупность физических и химических превращений веществ. Как ведут себя металлы в этом мире, с какими веществами они взаимодействуют и каким должно быть их практическое применение.
От чего зависят химические свойства металлов? ( Химические свойства металлов зависят от их активности)
Как делятся металлы по активности? Приведите примеры (По активности металлы делятся на активные (натрий, кальций) и неактивные (медь, ртуть))
Где и как можно узнать о активности металла? (В электрохимическом ряду активности металлов. Если металл стоит в ряду активности до водорода, то это активный металл. Если после водорода, то это неактивный металл)
Li K Ca Na Mg Al | Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt Au
Активные малоактивные неактивные
Химические свойства металлов делятся на две группы – с простыми веществами и сложными
Чем обусловлены химические свойства металлов?
1 Большим радиусом
2 Небольшим числом электронов на внешнем уровне
Чем, с точки зрения окислительно-восстановительных процессов, являются металлы в реакциях?
Ответ : Металлы являются только восстановителями, т.к их атомы легко отдают электроны, превращаясь при этом в положительно заряженные ионы – катионы.
М 0 – n е — →М n + . Чем обусловлены
Для того, чтобы прошла данная реакция необходимо наличие окислителя.
Вопрос к классу : Вспомните вещества, которые могут выступать в качестве окислителя при взаимодействии с металлами.
Составить список этих веществ: Кислород, галогены, сера, водород и др., вода, кислоты
Как называются продукты взаимодействия металлов с кислородом, галогенами, серой, азотом? (учащиеся дают ответы, сверяют их с записью на слайдах).
Эпиграф — высказывание М.В. Ломоносова: “Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции”. А сейчас на некоторое время вы станете химиками-аналитиками!
Правила техники безопасности.
Прокаливание медной пластинки в пламени спиртовки.
(признак реакции при прокаливании медной проволоки – изменение цвета, наблюдаем почернение – образование оксида меди ( II ), уравнение реакции 2 Cu + O 2 = 2 CuO )
Наблюдения, уравнения реакций записывают в рабочем листе.
Следующие два опыта мы посмотрим на видеофрагменте:
Демонстрационный опыт 1 (видеоклип): горение магния в кислороде.
Вопрос : Как вы можете объяснить этот опыт? Где подобный процесс мог применяться?
(В прошлом веке использовался фотографами для улучшения освещения)
Ученик у доски : Составляет уравнение реакции горения магния в кислороде, определяет окислитель и восстановитель.
Закрепление. Допишите уравнения реакций взаимодействия металлов с другими неметаллами.
2) Взаимодействие металлов с водой.
Как металлы реагируют с водой?
Активные металлы (Li – Na) + вода → гидроксид металла(щелочь) + Н2↑
Металлы средней активности (Mg – Pb) + вода → оксид металла + Н2↑
Неактивные металлы (Bi – Au) + вода → не реагируют
Посмотрите маленький фрагмент.
«Как вы думаете?» … имеет ли смысл фраза, которую мы слышали в сказке: «К морю синему пошли и море синее зажгли?».
Демонстрационный опыт 2 (видеоклип): Взаимодействие калия с водой.
Лабораторный опыт №2: взаимодействие натрия с водой:
Ученик у доски : Составляет уравнения реакции взаимодействия натрия с водой. Фиксирует признаки химической реакции, определяет окислитель и восстановитель. Уравнение реакции:
2 Na + 2 H 2 O = 2 NaOH + H 2
Почему металлы первой группы (А) называют щелочными? (образуется щелочь). Докажите! (капают в раствор фенолфталеин. Раствор окрасился в малиновый цвет, значит среда – щелочная,)
Закрепление. Допишите уравнения возможных реакций взаимодействия металлов водой.
Проблема: почему алюминий при обычных условиях не реагирует с водой? (алюминий прокрыт оксидной пленкой, которая его и защищает)
Это свойство имеет практическое значение, т.к. для изготовления посуды не берут калий, натрий, а именно алюминий, цинк, железо.
3) Взаимодействие металлов с кислотами.
Лабораторный опыт №3. Взаимодействие цинка, железа, меди с соляной кислотой. ТБ
1 вариант — Zn + HCl
2 вариант — Cu + HCl
3 вариант – Fe + HCl
Учитель: контролирует правила ТБ при выполнении опытов, навыки и умения экспериментальной работы.
Запись в тетрадях уравнений реакций,
Cu + HCl → не идёт
Это свойство используется для получения водорода в лаборатории.
Объясните результаты опыта.
Вывод. Металлы , стоящие в ряду активности до водорода вытесняют его из растворов кислот, а после водорода — не вытесняют. .
Но для этой реакции есть несколько поправок.
- Если образуется растворимая соль;
- Кроме щелочных и щелочноземельных металлов;
- Азотной кислота и . концентрированная серная кислота реагируют особенно, при этом никогда не выделяется водород.
4) Взаимодействие металлов с солями.
Лабораторный опыт № 4. Взаимодействие железа с сульфатом меди и меди с хлоридом железа ( III ).
Учитель: контролирует правила ТБ при выполнении опытов, навыки и умения экспериментальной работы.
Запись в тетрадях уравнений реакций, наблюдения
Fe + Cu SO 4 → Fe SO 4 + Cu
FeCl2 + Cu → не идет
Для этой реакции тоже есть поправки, которые совпадают с первой и второй поправкой для кислот
Объясните результаты опыта.
Вывод. Более активные металлы вытесняют менее активные из растворов их солей.
Закрепление. Допишите уравнения возможных реакций.
1. Решите тестовые задания
Тестовые задания по теме «Химические свойства металлов»
Задание: выберите один правильный ответ.
1.При взаимодействии кальция с водой образуются:
а) оксид кальция и водород;
б) гидроксид кальция и водород;
в) гидроксид кальция
2. Ртуть из раствора нитрата ртути (II) можно получить с помощью:
а) серебра; б) натрия; в) меди
3. Какой металл взаимодействует с водой с образованием оксида:
а) барий; б) хром; в) медь
4. С раствором серной кислоты с образованием соли и водорода реагирует:
а) ртуть; б) алюминий; в) золото
5. При взаимодействии с кислородом образует пероксид:
а) медь б) железо в) натрий
1.При взаимодействии цинка с водой образуются:
а) оксид цинка и водород;
б) гидроксид цинка и водород;
в) гидроксид цинка
2. Медь из раствора нитрата меди (II) можно получить с помощью:
а) серебра; б) натрия; в) железа
3. Какой металл взаимодействует с водой с образованием щелочи:
а) барий; б) хром; в) медь
4. С раствором серной кислоты с образованием соли и водорода реагирует:
а) ртуть; б) свинец; в) золото
5. При обычных условиях с азотом взаимодействует:
Источник



