- Нитрат свинца. Химические свойства, применение
- Гидролиз нитрата свинца (II)
- Общие сведения о гидролизе нитрата свинца (II)
- Гидролиз нитрата свинца (II)
- Примеры решения задач
- Нитрат свинца II
- Содержание
- История
- Физические свойства
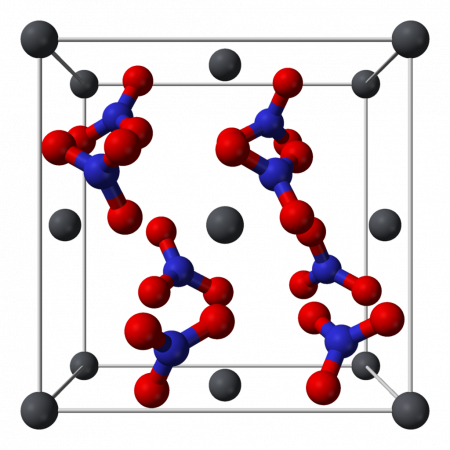
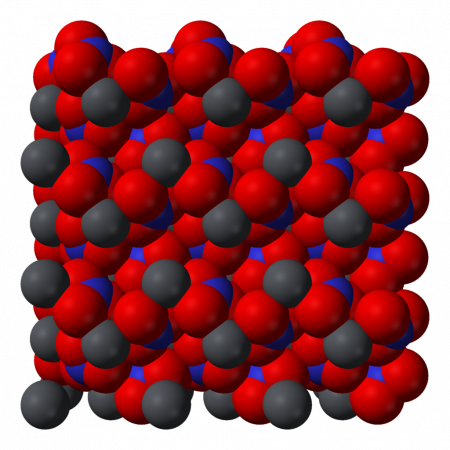
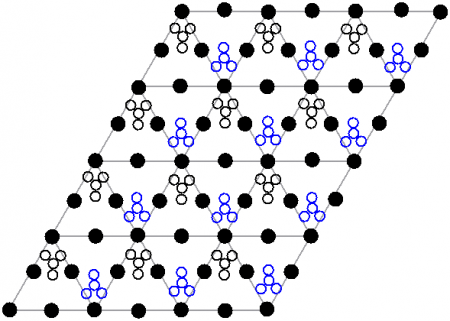
- Кристаллическая структура
- Получение
- Химические свойства
- Применение
- Меры предосторожности
Нитрат свинца. Химические свойства, применение
Нитрат свинца — это неорганическое соединение, имеющее следующую формулу: Pb(NO3)2. В обычном состоянии представляет собой порошок белого цвета или бесцветные кристаллы. Это вещество хорошо растворяется в воде.
Физические свойства
1. Хорошо растворяется с поглощением тепла в H2O (вода), плохо — в ацетоне , а также в метиловом и этиловом спиртах.
2. Образует диамагнитные бесцветные кристаллы, плотностью 4,530 г/сантиметр³. Каждый атом Pb (свинец) окружен двенадцатью атомами О (кислород). Длина связи Pb-O составляет 0,281 нм, а N-O — 0,127 нм. Представляет кубическую сингонию. Принадлежит к пространственной группе Pa3. Кроме кубической разновидности была получена еще и моноклинная форма, которая даже при нагревании плохо растворима в H2O (вода).
3. Свинец, температура плавления составляет 600,65 K.
Как получают нитрат свинца
Это вещество не встречается в природе. Поэтому люди создали некоторые методы (промышленные и лабораторные), которые сводятся к растворению свинца (Pb), его гидроксида или окиси в разбавленной азотной кислоте. Реакции:
3Pb (свинец) + 8HNO3 (кислота азотная) = 3Pb(NO3)2 (нитрат свинца) + 2NO (азота оксид, выделяется в виде газа) + 4H2O (вода);
PbO (окись свинца) + 2HNO3 (кислота азотная) = Pb(NO3)2 (свинца нитрат) + H2O (вода);
Pb(OH)2 (свинца гидроксид) + 2HNO3 (азотная кислота) = Pb(NO3)2 (динитрат свинца) + 3H2O (вода).
Для того чтобы подавить гидролиз и снизить растворимость динитрата свинца, азотную кислоту необходимо брать с избытком.
Также динитрат свинца получают как побочный продукт при очистке отходов кислотой азотной, например, при обработке висмуто-свинцовых отходов на заводах. В дальнейшем это соединение используют для цианирования золота.
Какие химические свойства есть у нитрата свинца
1. В водном растворе нитрат свинца диссоциирует на нитрат-анионы и катионы свинца. Вот так выглядит эта реакция:
Pb(NO3)2 (динитрат свинца) = Pb2+ (катион свинца) + 2NO3- (анион оксида азота)
Раствор динитрата свинца подвергается гидролизу. При избыточном количестве NO3- образуются нитратокомплексы: [Pb(NO3)6]3−, [Pb(NO3)4]2− и [Pb(NO3)3]−. Если повысить pH раствора, то в результате создаются гидронитраты Pb(OH)x(NO3)y переменного состава. Некоторые из них при этом выделены в твердом состоянии.
2. Так как свинца динитрат является растворимым соединением, то можно получить следующие обменные реакции:
2HCl (соляная кислота) + Pb(NO3)2 = PbCl2 (хлорид свинца, выпадает в осадок) + 2HNO3 (азотная кислота);
H2SO4 (кислота серная) + Pb(NO3)2 = PbSO4 (сульфат свинца, выпадает в осадок) + 2HNO3 (кислота азотная);
Pb(NO3)2 (свинца нитрат) + 2NaOH (натрия гидроксид) = Pb(OH)2 (свинца гидроксид, выпадает в осадок) + 2NaNO3 (нитрат натрия);
Pb(NO3)2 + 2NaN3 (азид натрия) = Pb(N3)2 (азид свинца, выпадает в осадок) + 2NaNO3 (нитрат натрия).
Любое химическое соединение, содержащее в себе свинцовый катион (Pb+2), будет реагировать с раствором, в котором есть анион йодид. При этом образуется осадок желто-оранжевого цвета (Pbl2, свинца йодид). Так выглядит данная реакция:
Pb2+ + 2l- = Pbl2 (осадок)
Такая же обменная реакция и в твердой фазе. Например:
Pb(NO3)2 + 2Kl (калий) = Pbl2 (выпадает в осадок) + 2KNO3 (нитрат калия)
Применение нитрата свинца
— используется в качестве начального сырья для производства большинства других соединений Pb (свинец);
— в качестве ингибитора нейлоновых полимеров и некоторых других полиэфиров, в роли зооцида, в покрытиях бумаги фототермографической;
— так как нитрат свинца — это доволно опасное соединение, в промышленной сфере в настоящее время используют другие соединения. Например, при производстве красок, спичек и фейерверков полностью отказались от соединений свинца.
— в лабораторной практике свинца нитрат используют как хороший и удобный источник диазота тетраоксида;
— сравнительно недавно в очень ограниченных количествах это химическое соединение используется при цианировании золота.
— в органической химии Pb(NO3)2 используется в качестве окислителя, для получения из дитиокарбаматов изотиоцианатов. Из-за своей высокой токсичности его применяют все реже.
Безопасность
Нитрат свинца классифицируется как категория 2А (вероятно канцерогенное соединение для человека). Недопустимо вдыхание его ядовитых паров или прием внутрь, а также контакт с кожными покровами или слизистой оболочкой. Динитрат свинца должен постоянно находиться под контролем. Отравления этим химическим соединением приводят к отравлениям, глиомам и раку почек, головного мозга и легких.
Источник
Гидролиз нитрата свинца (II)
Общие сведения о гидролизе нитрата свинца (II)
Формула – Pb(NO3)2. Представляет собой порошок белого цвета. Молярная масса – 331 г/моль.
Рис. 1. Внешний вид нитрата свинца (II).
Гидролиз нитрата свинца (II)
Гидролизуется по катиону. Характер среды водного раствора нитрата свинца (II) кислый. Уравнение гидролиза будет выглядеть следующим образом:
Pb 2+ + 2NO3 — + H2O↔PbOH + + H + + 2NO3 — (полное ионное уравнение);
Pb 2+ + H2O ↔ PbOH + + H + (сокращенное ионное уравнение);
Теоретически возможна вторая ступень:
Pb(OH)NO3↔PbOH + +NO3 — (диссоциация соли);
PbOH + + NO3 — + H2O ↔ Pb(OH)2 + H + + NO3 — (полное ионное уравнение);
PbOH + + H2O ↔ Pb(OH)2 + H + (сокращенное ионное уравнение);
Примеры решения задач
| Задание | Установите соответствие между названием соли и цветом индикатора в растворе этой соли. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ответ | а) нитрат бария представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом бария): Гидролизу не подвергается. Реакция среды раствора нитрата бария нейтральная, значит окраска лакмуса будет фиолетовой, а фенолфталеин будет бесцветным. Вариант 3. б) хлорид железа (III) представляет собой соль, образованную сильной кислотой (хлороводородной) и слабым основанием (гидроксидом железа (III)): Гидролизуется по катиону: Наличие ионов водорода свидетельствует о том, что реакция среды раствора хлорида железа (III) кислая, а значит окраска и лакмуса, и фенолфталеина будет красной. Вариант 4. в) сульфат аммония представляет собой соль, образованную сильной кислотой (серной) и слабым основанием (гидроксидом аммония): Гидролизуется по катиону: Наличие ионов водорода свидетельствует о том, что реакция среды раствора сульфата аммония кислая, а значит окраска и лакмуса, и фенолфталеина будет красной. Вариант 4. г) ацетат калия представляет собой соль, образованную слабой кислотой (уксусной) и сильным основанием (гидроксидом калия): Гидролизуется по аниону: Наличие гидроксид-ионов свидетельствует о том, что реакция среды раствора ацетата калия щелочная, а значит окраска лакмуса будет синей, а фенолфталеин останется бесцветным. Вариант 1. Источник Нитрат свинца II
Нитрат свинца II (Свинец азотнокислый) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде. СодержаниеИсторияИсторически первое промышленное применение нитрата свинца II — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца II), «хром оранжевый» (гидроксид-хромат свинца II) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий. В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса. Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах. В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны. Физические свойстваНитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне. Кристаллическая структураКристаллическая структура твердого динитрата свинца была определена с помощью нейтронной дифракции. Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм. Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решетке при высоких температурах, но это не подтвердилось. Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании. ПолучениеДинитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида: кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца. При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота. Химические свойстваДинитрат свинца хорошо растворяется в воде, давая бесцветный раствор. Растворимость сильно увеличивается при нагревании:
Водный раствор диссоциирует на катионы свинца и нитрат-анионы: Раствор нитрата свинца(II) подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель pH от 3,0 до 4,0 для 20 % водного раствора. При избытке ионов NO3 − в растворе образуются нитратокомплексы [Pb(NO3)3] − , [Pb(NO3)4] 2− и [Pb(NO3)6] 4− . При повышении pH раствора образуются гидроксонитраты переменного состава Pb(OH)x(NO3)y, некоторые из них выделены в твёрдом состоянии. Так как только динитрат и ацетат свинца II являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями: Любое соединение, содержащее катион свинца II, будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-жёлтого цвета (йодид свинца II). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь: Pb 2+ + 2 I − ⟶ PbI2 ↓ Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступке, происходит реакция: Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения. При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например, Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6. Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb 2+ -ион, который имеет стандартный редокс-потенциал (E 0 ) −0.125 V, или нитрат-ион, который в кислой среде имеет (E 0 ) +0.956 V . При нагревании кристаллов динитрата свинца они начинают разлагаться на оксид свинца II, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация: Благодаря этому свойству нитрат свинца иногда используется в пиротехнике. ПрименениеДинитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца. В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились. Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида. В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота. Примерно с 2000 года нитрат свинца II начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота). В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов. Он также нашёл применение для получения изотиоцианатов из дитиокарбаматов. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции. Меры предосторожностиДинитрат свинца токсичен и канцерогенен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³. При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца. Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase ) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери. Источник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||