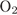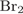- Оксид натрия: способы получения и химические свойства
- Способ получения
- Химические свойства
- Оксид натрия, характеристика, свойства и получение, химические реакции
- Оксид натрия, характеристика, свойства и получение, химические реакции.
- Краткая характеристика оксида натрия:
- Физические свойства оксида натрия:
- Получение оксида натрия:
- Химические свойства оксида натрия. Химические реакции оксида натрия:
- Применение и использование оксида натрия:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Экзаменационные задания. 1. Задание 18 № 21. Взаимодействие оксида натрия с водой относится к реакциям
Оксид натрия: способы получения и химические свойства
Оксид натрия Na2O — бинарное неорганическое вещество . Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород :
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами :
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия :
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой . Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Источник
Оксид натрия, характеристика, свойства и получение, химические реакции
Оксид натрия, характеристика, свойства и получение, химические реакции.
Оксид натрия – неорганическое вещество, имеет химическую формулу Na2O.
Краткая характеристика оксида натрия:
Оксид натрия – неорганическое вещество бесцветного либо белого цвета.
Так как валентность натрия равна одному, то оксид натрия содержит один атом кислорода и два атома натрия.
Химическая формула оксида натрия Na2O.
Оксид натрия в воде не растворяется, а вступает в реакцию с ней. Не растворяется в этаноле, вступает с ним в реакцию.
Оксид натрия относится к опасным веществам. Это едкое вещество, особенно опасен при смешивании с водой.
Физические свойства оксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2O |
| Синонимы и названия иностранном языке | sodium oxide (англ.) |
окись натрия (рус.)
Получение оксида натрия:
Оксид натрия получается в результате следующих химических реакций:
- 1. из пероксида натрия:
При реакции натрия с кислородом образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия.
Затем пероксид натрия обогащают натрием.
- 2. путем нагревания нитрата (нитрита) натрия с металлическим натрием:
- 3. путем взаимодействия гидроксида натрия с металлическим натрием:
- 4. путем прокаливания карбоната натрия:
Химические свойства оксида натрия. Химические реакции оксида натрия:
Химически активное вещество.
Химические свойства оксида натрия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
- 1. реакция оксида натрия с кислородом:
В результате реакции образуется пероксид натрия.
- 2. реакция оксида натрия с водой:
Оксид натрия бурно реагирует с водой , образуя гидроксид натрия.
- 3. реакция оксида натрия с оксидом углерода (углекислым газом):
Оксид натрия реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат натрия .
- 4. реакция оксида натрия с оксидом серы:
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит натрия, во втором случае – сульфат натрия.
- 5. реакция оксида натрия с оксидом кремния:
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат натрия.
- 6. реакция оксида натрия с оксидом фосфора :
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль – ортофосфат натрия.
Аналогично проходят реакции оксида натрия и с другими кислотными оксидами.
- 7. реакция оксида натрия с оксидом алюминия :
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат натрия.
Аналогично проходят реакции оксида натрия и с другими амфотерными оксидами.
- 8. реакция оксида натрия с оксидом меди :
В результате реакции образуется соль – купрат натрия.
- 9. реакция оксида натрия с оксидом железа :
В результате реакции образуется соль – феррат натрия.
- 10. реакция оксида натрия с оксидом свинца :
В результате реакции образуется соль – плюмбит натрия.
Аналогично проходят реакции оксида натрия и с другими оксидами.
- 11. реакция оксида натрия с оксидом азота (II) и оксидом азота (IV):
В результате реакции образуются соль нитрит натрия.
- 12. реакция оксида натрия с плавиковой кислотой:
В результате химической реакции получается соль – фторид натрия и вода.
- 13. реакция оксида натрия с азотной кислотой:
В результате химической реакции получается соль – нитрат натрия и вода .
Аналогично проходят реакции оксида натрия и с другими кислотами.
- 14. реакция оксида натрия с бромистым водородом (бромоводородом):
В результате химической реакции получается соль – бромид натрия и вода .
- 15. реакция оксида натрия с йодоводородом:
В результате химической реакции получается соль – йодид натрия и вода .
- 16. реакция оксида натрия с жидким аммиаком:
В результате химической реакции получается гидроксид натрия и амид натрия.
- 17. реакция термического разложения оксида натрия:
Оксид натрия в результате термического разложения разлагается на пероксид натрия и натрий.
Применение и использование оксида натрия:
Оксид натрия используется в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Примечание: © Фото //www.pexels.com, //pixabay.com

оксид натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида натрия
реакции с оксидом натрия
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 487)
- Экономика Второй индустриализации России (102 476)
- Программа искусственного интеллекта ЭЛИС (27 495)
- Метан, получение, свойства, химические реакции (23 750)
- Этилен (этен), получение, свойства, химические реакции (22 846)
- Природный газ, свойства, химический состав, добыча и применение (21 176)
- Крахмал, свойства, получение и применение (20 583)
- Целлюлоза, свойства, получение и применение (19 438)
- Пропилен (пропен), получение, свойства, химические реакции (19 121)
- Прямоугольный треугольник, свойства, признаки и формулы (18 742)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Экзаменационные задания. 1. Задание 18 № 21. Взаимодействие оксида натрия с водой относится к реакциям
1. Задание 18 № 21. Взаимодействие оксида натрия с водой относится к реакциям
1) соединения, необратимым
2) обмена, обратимым
3) соединения, обратимым
4) обмена, необратимым
2. Задание 18 № 163. Взаимодействие оксида углерода (IV) с водой относится к реакциям
1) соединения, необратимым
2) обмена, обратимым
3) соединения, обратимым
4) обмена, необратимым
3. Задание 18 № 2344. Взаимодействие между какими веществами является реакцией обмена?
1) железо и сера
2) ацетилен и бром
3) этилен и вода
4) уксусная кислота и гидроксид магния
4. Задание 18 № 2430. К необратимым реакциям относят
1) взаимодействие азота с водородом
2) гидролиз карбоната натрия
3) гидролиз карбида кальция
4) взаимодействие этилового спирта с уксусной кислотой
5. Задание 18 № 2516. Взаимодействие между какими веществами является реакцией замещения?
1) этен и хлороводород
2) ацетилен и вода
3) этилен и вода
6. Задание 18 № 2602. Окислительно-восстановительной реакцией является разложение
1) перманганата калия
2) хлорида аммония
3) гидрокарбоната кальция
4) кремниевой кислоты
7. Задание 18 № 2645. Окислительно-восстановительной не является реакция
1) цинка с соляной кислотой
2) натрия с этанолом
3) оксида бария с соляной кислотой
4) фосфора с кислородом
8. Задание 18 № 2903. Нитрование бензола относится к реакциям
9. Задание 18 № 3032. Взаимодействие железа с хлороводородной кислотой относится к реакциям
10. Задание 18 № 3075. Реакция между карбонатом натрия и соляной кислотой является одновременно реакцией
1) соединения и обратимой
2) обмена и необратимой
3) замещения и необратимой
4) обмена и обратимой
11. Задание 18 № 3247. Взаимодействие пропилена с бромом при обычных условиях относится к реакциям
12. Задание 18 № 3290. К реакциям обмена относят
1) дегидрирование спиртов
2) галогенирование алканов
3) реакцию щелочных металлов с водой
4) реакцию нейтрализации
13. Задание 18 № 4242. Оксид цинка вступает в реакцию соединения с
1)
2)
3)
4)
14. Задание 18 № 4282. Алюминий вступает в реакцию замещения с
1)
2)
3)
4)
15. Задание 18 № 4364. Взаимодействие этанола с хлороводородом относится к реакциям
16. Задание 18 № 4404. Взаимодействие кислорода с оксидом серы (IV) относится к реакциям
1) соединения, эндотермичеким
2) обмена, обратимым
3) замещения, экзотермическим
4) соединения, обратимым
17. Задание 18 № 4444. Толуол вступает в реакцию замещения с
1)
2)
3)
4)
18. Задание 18 № 4484. Бензол вступает в реакцию присоединения с
1)
2)
3)
4)
19. Задание 18 № 4537. К реакциям замещения относится взаимодействие брома с
4) бромидом железа (II)
20. Задание 18 № 4577. В реакции электрофильного присоединения вступает
4) уксусная кислота
21. Задание 18 № 4617. В реакции электрофильного замещения вступает
22. Задание 18 № 4681. Взаимодействие этанола с уксусной кислотой относится к реакциям
23. Задание 18 № 4721. Взаимодействие азота с водородом относится к реакциям
Источник