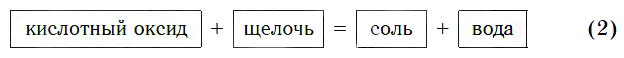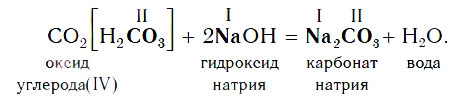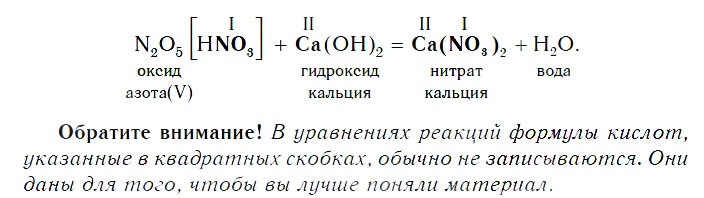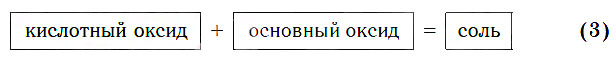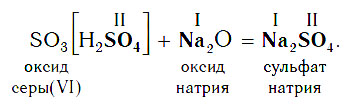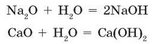Урок 32. Химические свойства оксидов
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.
Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
1. Химические свойства кислотных оксидов
а) Взаимодействие с водой
Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:
Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами
Все кислотные оксиды реагируют со щелочами по общей схеме:
В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:
Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
в) Реакции с основными оксидами
Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
2. Химические свойства основных оксидов
а) Взаимодействие с водой
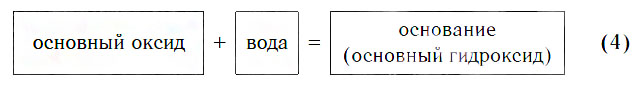
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:
К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
в) Взаимодействие с кислотными оксидами
Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.
- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Взаимодействие оксида с водой называется
Понятие о кислотах и основаниях
Многие оксиды способны вступать в химические реакции с водой. Обычно эти реакции являются реакциями соединения, в результате которых образуются продукты присоединения воды к оксидам. Вещества, образующиеся путем соединения воды с другими веществами, называют гидратами.
В зависимости от того, с каким оксидом взаимодействует вода, может образоваться два типа гидратов: кислоты и основания. Кислоты состоят из атомов Гидрогена и кислотного остатка (H2SO4, ^ТОд), а в формулах оснований на первое место записывают металлический элемент, с которым соединяется гидроксильная группа — ОН (KOH, Ba(OH)2). В зависимости от гидрата, соответствующему определенному оксиду, среди оксидов выделяют две группы: кислотные оксиды. и основные оксиды.
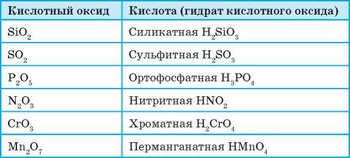
Все кислотные оксиды, за исключением силиций(^) оксида SiО2, в обычных условиях вступают в реакции соединения с водой с образованием кислот:
Оксиды, гидраты которых являются кислотами, называют кислотными оксидами.
Большинство кислотных оксидов — это оксиды неметаллических элементов. Но кислотные оксиды могут образовывать и металлические элементы, если эти элементы могут проявлять высокие валентности, выше четырех. Так, к кислотным оксидам относится хром(У1) оксид Сг03 и манган(УП) оксид Мп207.
Формулы наиболее употребляемых кислотных оксидов и соответствующих им кислот приведены в таблице 5.
Продукты реакции оксидов с водой (гидраты) могут проявлять основные свойства. Если гидрат оксида является основанием, то такой оксид — основный.
Оксиды, гидраты которых являются основаниями, называют основными оксидами.
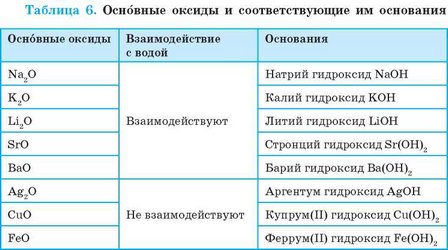
К основным оксидам относятся оксиды металлических элементов. Это, как правило, оксиды одно-, дву-, а иногда трехвалентных металлических элементов (табл. 6).
Большинство основных оксидов с водой не взаимодействуют. В реакцию с водой вступают лишь оксиды, гидраты которых растворяются в воде (см. табл. 6, с. 161). Такие гидраты называют щелочами:
• Единственный кислотный оксид, который в обычных условиях не взаимодействует с водой,— это силиций(1У) оксид SiO2, которому соответствует силикатная кислота H2SiO3. Он широко распространен в природе в составе минерала кварца. Обычный кварцевый песок на берегах морей и рек — это и есть силиций(1У) оксид.
• При взаимодействии кальций оксида (негашеной извести) с водой образуется кальций гидроксид (гашеная известь). Во время этой реакции выделяется так много теплоты, что вода может закипеть. Эту реакцию используют в так называемых химических грелках для разогревания завтраков или напитков в одноразовых пакетах.
Выявление кислот и оснований в растворах
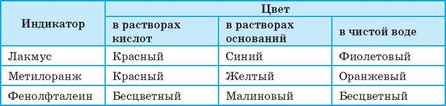
Большинство оксидов и соответствующих им гидратов — бесцветные соединения, поэтому выявить их наличие или различить кислоты и основания без «посторонней помощи» невозможно. Для выявления кислот и оснований в растворах используют индикаторы — сложные органические соединения, которые изменяют свою окраску в зависимости от наличия кислоты или основания в растворе (рис. 114). Наиболее употребляемые индикаторы и их цвет при наличии кислот и оснований приведены в таблице 7.
Таблица 7. Цвет некоторых индикаторов при наличии кислот, оснований и в воде
Чаще всего индикаторы используют в виде растворов — в воде или спирте. Удобнее использовать индикаторную бумагу — обычную бумагу, пропитанную раствором индикатора (рис. 115).
ЛАБОРАТОРНЫЙ ОПЫТ № 5
Испытание водных растворов кислот и щелочей индикаторами
Оборудование: штатив с пробирками.
Реактивы: растворы основания, кислоты, вода, метилоранж, фенолфталеин, лакмус.
• для опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза.
1. Подготовьте по три пробирки с водой, раствором кислоты и раствором основания.
2. В первую пробирку с водой добавьте несколько капель раствора метилоранжа, во вторую — лакмуса, в третью — фенолфталеина.
3. Добавьте индикаторы к растворам кислоты и основания.
4. Сравните цвет индикаторов в разных пробирках. Запишите результаты в тетрадь.
1. Оксиды способны соединяться с водой с образованием гидратов. Гидраты кислотных оксидов — кислоты, а основных — основания.
2. К кислотным оксидам относятся оксиды неметаллических элементов и оксиды металлических элементов с валентностью выше IV. К основным оксидам относятся оксиды металлических элементов с валентностью I, II и иногда 111.
3. Для выявления кислот и оснований в растворе используют индикаторы — вещества, цвет которых изменяется при наличии кислоты или основания.
1. Какие оксиды называют кислотными, а какие — основными?
2. Какие вещества называют гидратами?
3. Какие оксиды (кислотные и основные) в обычных условиях взаимодействуют с водой, а какие — нет?
Задания для усвоения материала
1. Приведите уравнения реакций кислотных и основных оксидов с водой.
2. Из приведенного перечня выпишите отдельно формулы оксидов: а) кислотных; б) основных. №20, Р205, С02, SO3, СгО, Си20, SiО2, Мп207.
3. Какие из приведенных оксидов взаимодействуют с водой? Составьте соответствующие уравнения реакций. №20, С02, SO3, СгО, SiО2.
4. Раствор, который образовался при растворении газообразного оксида в воде, окрашивает лакмус в красный цвет. Какой это газ мог бы быть? Составьте уравнения реакций.
5. Гашение извести — это взаимодействие негашеной извести (кальций оксида) с водой. Составьте уравнение этой реакции.
6. Как вы считаете, существуют ли в природных условиях фосфор(У) оксид, сульфур(У1) оксид и натрий оксид? Ответ обоснуйте.
7. Дополните схемы реакций и назовите продукты реакции:
8*. Некоторые оксиды используют как осушители для обезвоживания газов. На каком принципе основано действие оксидов как осушителей? Какие оксиды можно для этого использовать и почему?
Источник
Взаимодействие оксида с водой называется
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
Na I 2O – оксид натрия; Са II О – оксид кальция;
S IV O2 – оксид серы (IV); S VI O3 – оксид серы (VI).
По химическим свойствам оксиды делятся на две группы:
1. Несолеобразующие (безразличные) – не образуют солей, например: NO, CO, H2O;
2. Солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3 .
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.
Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2.
Источник