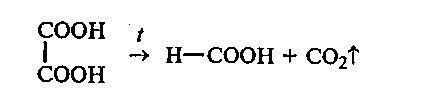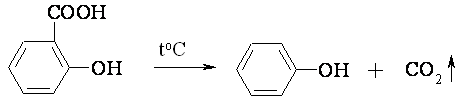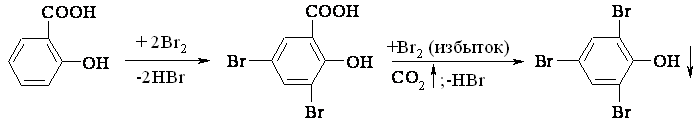- Опыт 27. Взаимодействие бензойной и салициловой кислот с бромной водой
- Опыт 28. Отношение бензойной кислоты к перманганату калия
- Опыт 29. Свойства олеиновой кислоты
- 5.2. Двухосновные карбоновые кислоты Опыт 30. Свойства щавелевой кислоты
- Опыт 27. Взаимодействие бензойной и салициловой кислот с бромной водой
- Опыт 28. Отношение бензойной кислоты к перманганату калия
- Опыт 29. Свойства олеиновой кислоты
- 5.2. Двухосновные карбоновые кислоты Опыт 30. Свойства щавелевой кислоты
- Органическая химия: Лабораторный практикум , страница 23
- Опыт № 62. Термическое декарбоксилирование салициловой кислоты
- Опыт № 63. Взаимодействие салициловой кислоты с хлоридом железа (III)
- Опыт № 64. Взаимодействие салициловой и бензойной кислот с бромом
- Опыт № 65. Взаимодействие галловой кислоты и танина с хлоридом железа (III)
Опыт 27. Взаимодействие бензойной и салициловой кислот с бромной водой
Реактивы и оборудование: насыщенные растворы бензойнойи салициловой кислот, бромная вода (насыщенная); пипетки,пробирки.
В две пробирки наливают по 1—2 мл насыщенных растворов бензойной, салициловой кислот. В каждую пробирку добавляют по несколько капель насыщенной бромной воды. В пробирке с бензойной кислотой бромная вода не обесцвечивается, так как бензойная кислота бромируется только в присутствии катализатора. Салициловая кислота обесцвечивает бромную воду:
Напишите механизмы данных реакций. Объясните, почему бензойная кислота не взаимодействует с бромом при данных условиях.
Опыт 28. Отношение бензойной кислоты к перманганату калия
Реактивы и оборудование: бензойная кислота, 10%-ный раствор карбоната натрия, 5%-ный раствор перманганата калия, пробирки.
Небольшое количество (0,1 г) бензойной кислоты растворяют в минимальном объеме 10%-ного раствора карбоната натрия. В раствор при перемешивании добавляют раствор перманганата калия. Что происходит? Объясните.
Опыт 29. Свойства олеиновой кислоты
Реактивы и оборудование: олеиновая кислота, 2%-ный раствор перманганата калия, 10%-ный раствор карбоната натрия, бромная вода (насыщенная), пробирки.
29.1 Взаимодействие олеиновой кислоты с бромной водой. В пробирку наливают 1 мл бромной воды и 1 мл олеиновой кислоты. Смесь энергично перемешивают. Наблюдают обесцвечивание бромной воды.
Рассмотрите механизм этой реакции.
29.2. Окисление олеиновой кислоты перманганатом калия (реакция Вагнера). В пробирку вносят 1,5 мл 2%-ного раствора перманганата калия, 1,5 мл 10%-ного раствора карбоната натрия и 0,5 мл олеиновой кислоты. Полученную смесь энергично встряхивают. Наблюдают, что фиолетовая окраска перманганата калия переходит в бурую и выпадает осадок оксида марганца (IV):
Какие свойства проявляет олеиновая кислота в данных реакциях?
5.2. Двухосновные карбоновые кислоты Опыт 30. Свойства щавелевой кислоты
Реактивы и оборудование: кристаллическая щавелевая кислота, насыщенный раствор щавелевой кислоты, 1М раствор щавелевой кислоты, 2М раствор гидроксида калия, 10%-ный раствор серной кислоты, 5%-ный раствор перманганата калия, известковая вода; изогнутые газоотводные трубки, газоотводные трубки с оттянутым концом, пробирки.
30.1. Получение калиевых солей щавелевой кислоты. В пробирку наливают 2 мл 1М раствора щавелевой кислоты и добавляют 1 мл 2М раствора гидроксида калия. Наблюдают выпадение осадка кислой калиевой соли щавелевой кислоты:
К осадку добавляют избыток гидроксида калия и наблюдают его растворение вследствие образования средней соли щавелевой кислоты:
30.2. Декарбоксилирование щавелевой кислоты при нагревании. В сухую пробирку вносят
1 г щавелевой кислоты. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой опускают в пробирку с известковой водой, и нагревают. При нагревании щавелевая кислота декарбоксилируется. Выделяющийся оксид углерода (IV) обнаруживают по помутнению известковой воды.
30.3. Окисление щавелевой кислоты перманганатом калия. В пробирку наливают 1 мл насыщенного раствора щавелевой кислоты, добавляют 1 мл 10%-ного раствора серной кислоты и 2 мл 5%-ного раствора перманганата калия. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой погружают в известковую воду. Реакционную смесь несильно нагревают. Раствор быстро обесцвечивается, а известковая вода мутнеет.
Сделайте вывод о химических свойствах щавелевой кислоты.
Источник
Опыт 27. Взаимодействие бензойной и салициловой кислот с бромной водой
Реактивы и оборудование: насыщенные растворы бензойнойи салициловой кислот, бромная вода (насыщенная); пипетки,пробирки.
В две пробирки наливают по 1—2 мл насыщенных растворов бензойной, салициловой кислот. В каждую пробирку добавляют по несколько капель насыщенной бромной воды. В пробирке с бензойной кислотой бромная вода не обесцвечивается, так как бензойная кислота бромируется только в присутствии катализатора. Салициловая кислота обесцвечивает бромную воду:
Напишите механизмы данных реакций. Объясните, почему бензойная кислота не взаимодействует с бромом при данных условиях.
Опыт 28. Отношение бензойной кислоты к перманганату калия
Реактивы и оборудование: бензойная кислота, 10%-ный раствор карбоната натрия, 5%-ный раствор перманганата калия, пробирки.
Небольшое количество (0,1 г) бензойной кислоты растворяют в минимальном объеме 10%-ного раствора карбоната натрия. В раствор при перемешивании добавляют раствор перманганата калия. Что происходит? Объясните.
Опыт 29. Свойства олеиновой кислоты
Реактивы и оборудование: олеиновая кислота, 2%-ный раствор перманганата калия, 10%-ный раствор карбоната натрия, бромная вода (насыщенная), пробирки.
29.1 Взаимодействие олеиновой кислоты с бромной водой. В пробирку наливают 1 мл бромной воды и 1 мл олеиновой кислоты. Смесь энергично перемешивают. Наблюдают обесцвечивание бромной воды.
Рассмотрите механизм этой реакции.
29.2. Окисление олеиновой кислоты перманганатом калия (реакция Вагнера). В пробирку вносят 1,5 мл 2%-ного раствора перманганата калия, 1,5 мл 10%-ного раствора карбоната натрия и 0,5 мл олеиновой кислоты. Полученную смесь энергично встряхивают. Наблюдают, что фиолетовая окраска перманганата калия переходит в бурую и выпадает осадок оксида марганца (IV):
Какие свойства проявляет олеиновая кислота в данных реакциях?
5.2. Двухосновные карбоновые кислоты Опыт 30. Свойства щавелевой кислоты
Реактивы и оборудование: кристаллическая щавелевая кислота, насыщенный раствор щавелевой кислоты, 1М раствор щавелевой кислоты, 2М раствор гидроксида калия, 10%-ный раствор серной кислоты, 5%-ный раствор перманганата калия, известковая вода; изогнутые газоотводные трубки, газоотводные трубки с оттянутым концом, пробирки.
30.1. Получение калиевых солей щавелевой кислоты. В пробирку наливают 2 мл 1М раствора щавелевой кислоты и добавляют 1 мл 2М раствора гидроксида калия. Наблюдают выпадение осадка кислой калиевой соли щавелевой кислоты:
К осадку добавляют избыток гидроксида калия и наблюдают его растворение вследствие образования средней соли щавелевой кислоты:
30.2. Декарбоксилирование щавелевой кислоты при нагревании. В сухую пробирку вносят
1 г щавелевой кислоты. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой опускают в пробирку с известковой водой, и нагревают. При нагревании щавелевая кислота декарбоксилируется. Выделяющийся оксид углерода (IV) обнаруживают по помутнению известковой воды.
30.3. Окисление щавелевой кислоты перманганатом калия. В пробирку наливают 1 мл насыщенного раствора щавелевой кислоты, добавляют 1 мл 10%-ного раствора серной кислоты и 2 мл 5%-ного раствора перманганата калия. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой погружают в известковую воду. Реакционную смесь несильно нагревают. Раствор быстро обесцвечивается, а известковая вода мутнеет.
Сделайте вывод о химических свойствах щавелевой кислоты.
Источник
Органическая химия: Лабораторный практикум , страница 23
Опыт № 62. Термическое декарбоксилирование салициловой кислоты
Кристаллическая салициловая кислота
Раствор хлорида железа
В сухую пробирку помещают несколько кристаллов салициловой кислоты (
0,5 г) и нагревают в пламени горелки до плавления и кипения. Кислота частично возгоняется (на холодных стенках пробирки появляется
белый налет) и частично декарбоксилируется (при 230-250 0 С), т.е. превращается в фенол по следующей схеме:
Для доказательства образования фенола, пробирку охлаждают (на воздухе, под тягой!), затем в нее наливают
1 мл воды и к полученному раствору добавляют несколько капель раствора хлорида железа (III). Раствор окрашивается в фиолетовый цвет (качественная реакция на фенол).
Опыт № 63. Взаимодействие салициловой кислоты с хлоридом железа (III)
Раствор салициловой кислоты
Раствор хлорида железа (III)
Налить в пробирку
1 мл салициловой кислоты, добавить
1 каплю хлорида железа (III). Образующееся фиолетовое окрашивание указывает на наличие гидроксильной группы связанной с бензольным ядром.
Опыт № 64. Взаимодействие салициловой и бензойной кислот с бромом
Берут две пробирки. В одну наливают
1 мл насыщенного раствора бензойной кислоты, в другую, соответственно, такой же объем насыщенного раствора салициловой кислоты и добавляют, в каждую из них, по каплям бромную воду.
Бензойная кислота не обесцвечивает бромную воду.
Салициловая кислота легко бромируется, обесцвечивая бромную воду с образованием осадка 3,5-дибромсалициловой кислоты. При добавлении избытка бромной воды салициловая кислота декарбоксилируется, образуя осадок 2,4,6–трибромфенола:
Опыт № 65. Взаимодействие галловой кислоты и танина с хлоридом железа (III)
Раствор хлорида железа (III)
Галловая кислота (3,4,5-триоксибензойная кислота) хорошо растворима в воде. В виде дигалловой кислоты она входит в состав танина. В одну пробирку наливают
1 мл 1%-го водного раствора галловой кислоты, в другую
1 мл водного раствора танина. В каждую из них добавляют по несколько капель 2%-ного раствора хлорида железа (III). При этом раствор галловой кислоты окрашивается в зелено-черный цвет, а раствор танина — в сине-зеленый. Появление окраски с хлоридом железа (III) указывает на наличие в галловой кислоте и танине свободных фенольных гидроксилов.
- АлтГТУ 419
- АлтГУ 113
- АмПГУ 296
- АГТУ 267
- БИТТУ 794
- БГТУ «Военмех» 1191
- БГМУ 172
- БГТУ 603
- БГУ 155
- БГУИР 391
- БелГУТ 4908
- БГЭУ 963
- БНТУ 1070
- БТЭУ ПК 689
- БрГУ 179
- ВНТУ 120
- ВГУЭС 426
- ВлГУ 645
- ВМедА 611
- ВолгГТУ 235
- ВНУ им. Даля 166
- ВЗФЭИ 245
- ВятГСХА 101
- ВятГГУ 139
- ВятГУ 559
- ГГДСК 171
- ГомГМК 501
- ГГМУ 1966
- ГГТУ им. Сухого 4467
- ГГУ им. Скорины 1590
- ГМА им. Макарова 299
- ДГПУ 159
- ДальГАУ 279
- ДВГГУ 134
- ДВГМУ 408
- ДВГТУ 936
- ДВГУПС 305
- ДВФУ 949
- ДонГТУ 498
- ДИТМ МНТУ 109
- ИвГМА 488
- ИГХТУ 131
- ИжГТУ 145
- КемГППК 171
- КемГУ 508
- КГМТУ 270
- КировАТ 147
- КГКСЭП 407
- КГТА им. Дегтярева 174
- КнАГТУ 2910
- КрасГАУ 345
- КрасГМУ 629
- КГПУ им. Астафьева 133
- КГТУ (СФУ) 567
- КГТЭИ (СФУ) 112
- КПК №2 177
- КубГТУ 138
- КубГУ 109
- КузГПА 182
- КузГТУ 789
- МГТУ им. Носова 369
- МГЭУ им. Сахарова 232
- МГЭК 249
- МГПУ 165
- МАИ 144
- МАДИ 151
- МГИУ 1179
- МГОУ 121
- МГСУ 331
- МГУ 273
- МГУКИ 101
- МГУПИ 225
- МГУПС (МИИТ) 637
- МГУТУ 122
- МТУСИ 179
- ХАИ 656
- ТПУ 455
- НИУ МЭИ 640
- НМСУ «Горный» 1701
- ХПИ 1534
- НТУУ «КПИ» 213
- НУК им. Макарова 543
- НВ 1001
- НГАВТ 362
- НГАУ 411
- НГАСУ 817
- НГМУ 665
- НГПУ 214
- НГТУ 4610
- НГУ 1993
- НГУЭУ 499
- НИИ 201
- ОмГТУ 302
- ОмГУПС 230
- СПбПК №4 115
- ПГУПС 2489
- ПГПУ им. Короленко 296
- ПНТУ им. Кондратюка 120
- РАНХиГС 190
- РОАТ МИИТ 608
- РТА 245
- РГГМУ 117
- РГПУ им. Герцена 123
- РГППУ 142
- РГСУ 162
- «МАТИ» — РГТУ 121
- РГУНиГ 260
- РЭУ им. Плеханова 123
- РГАТУ им. Соловьёва 219
- РязГМУ 125
- РГРТУ 666
- СамГТУ 131
- СПбГАСУ 315
- ИНЖЭКОН 328
- СПбГИПСР 136
- СПбГЛТУ им. Кирова 227
- СПбГМТУ 143
- СПбГПМУ 146
- СПбГПУ 1599
- СПбГТИ (ТУ) 293
- СПбГТУРП 236
- СПбГУ 578
- ГУАП 524
- СПбГУНиПТ 291
- СПбГУПТД 438
- СПбГУСЭ 226
- СПбГУТ 194
- СПГУТД 151
- СПбГУЭФ 145
- СПбГЭТУ «ЛЭТИ» 379
- ПИМаш 247
- НИУ ИТМО 531
- СГТУ им. Гагарина 114
- СахГУ 278
- СЗТУ 484
- СибАГС 249
- СибГАУ 462
- СибГИУ 1654
- СибГТУ 946
- СГУПС 1473
- СибГУТИ 2083
- СибУПК 377
- СФУ 2424
- СНАУ 567
- СумГУ 768
- ТРТУ 149
- ТОГУ 551
- ТГЭУ 325
- ТГУ (Томск) 276
- ТГПУ 181
- ТулГУ 553
- УкрГАЖТ 234
- УлГТУ 536
- УИПКПРО 123
- УрГПУ 195
- УГТУ-УПИ 758
- УГНТУ 570
- УГТУ 134
- ХГАЭП 138
- ХГАФК 110
- ХНАГХ 407
- ХНУВД 512
- ХНУ им. Каразина 305
- ХНУРЭ 325
- ХНЭУ 495
- ЦПУ 157
- ЧитГУ 220
- ЮУрГУ 309
Полный список ВУЗов
Чтобы распечатать файл, скачайте его (в формате Word).
Источник