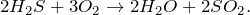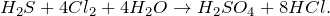- Сероводород H2S и сульфиды- химические свойства
- Сульфиды — получение и химический свойства
- Сероводород
- Сероводород
- Строение молекулы и физические свойства
- Способы получения сероводорода
- Химические свойства сероводорода
- Сера. Сероводород
- Нахождение в природе
- Получение
- Химические свойства серы
- H2S + H2O = ? уравнение реакции
- Пожалуйста, зарегистрируйтесь или войдите, чтобы добавить ответ.
- H2S + Cl2 + H2O = ? уравнение реакции
Сероводород H2S и сульфиды- химические свойства
Физические свойства сероводорода:
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в 1V H2O растворяется 3V H2S при н.у.); t°пл. = -86°C; t°кип. = -60°С.
Получение сероводорода:
1) Из простых веществ: H2 + S t° → H2S
2) Реакцией обмена: FeS + 2HCl→FeCl2 + H2S
Химические свойства сероводорода:
1) Раствор H2S в воде – слабая двухосновная кислота.
Сероводородная кислота образует два ряда солей — средние (сульфиды) и кислые (гидросульфиды).
2) Взаимодействует с основаниями:
3) Качественная реакция на сероводород и растворимые сульфиды — образование темно-коричневого (почти черного) осадка PbS:
4) H2S проявляет очень сильные восстановительные свойства:
5) Сероводород окисляется кислородом:
при недостатке O2
6) Серебро при контакте с сероводородом чернеет:
Сульфиды — получение и химический свойства
Получение сульфидов:
1) Многие сульфиды получают нагреванием металла с серой:
Hg + S → HgS (при комнатной температуре)
2) Растворимые сульфиды получают действием сероводорода на щелочи:
3) Нерастворимые сульфиды получают обменными реакциями:
Химические свойства сульфидов:
1) Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
S 2- + H2O ↔ HS — + OH —
2) Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
3) Водорастворимые сульфиды растворяют серу с образованием полисульфидов:
Полисульфиды при окислении превращаются в тиосульфаты, например:
Источник
Сероводород
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Источник
Сера. Сероводород
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.
В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII – XIV вв., после появления пороха и огнестрельного оружия. Главным поставщиком серы была Италия.

В наши дни сера используется как сырьё для производства серной кислоты, пороха, при вулканизации каучука, в органическом синтезе, а также для борьбы с вредителями сельского хозяйства. Порошок серы применяют в медицине в качестве наружного дезинфицирующего средства.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая сера представляет собой жёлтый порошок, нерастворимый в воде. При кристаллизации из хлороформа CHCl3 или из сероуглерода CS2 она выделяется в виде прозрачных кристаллов октаэдрической формы. ромбическая сера состоит из циклических молекул S8, имеющих форму короны. При 113 о С она плавится, превращаясь в жёлтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нем образуются цепочки. А если нагреть серу до 445 о С, она закипает. Выливая кипящую серу струйкой в холодную воду, можно получить пластическую серу – резиноподобную модификацию, состоящую из полимерных цепочек. При медленном охлаждении расплава образуются игольчатые кристаллы моноклинной серы (tпл = 119 о С). Подобно ромбической сере, эта модификация состоит из молекул S8. При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.
Нахождение в природе
В природе сера находится как в свободном состоянии, так и в виде соединений. Важнейшие из них следующие: FeS2 – пирит; или железный (серный) колчедан, CuS – медный блеск, Ag2S – серебряный блеск, PbS – свинцовый блеск. Сера часто встречается в виде сульфатов: гипса – CaSO4 ∙2H2O; мирабилита, или глауберовой соли Na2SO4∙10H2O; горькой (английской) соли MgSO4 ∙ 7H2O и др. Сера входит в состав нефти, каменного угля, содержится в растительных и животных организмах (в составе белков).
Получение
Серу, содержащуюся в свободном состоянии (в виде включений) в горных породах, выплавляют из них в специальных аппаратах – автоклавах.
В лабораторных условиях свободную серу можно получить, например, при сливании растворов сероводородной и сернистой кислот, при неполном сгорании сероводорода:
Химические свойства серы
Сера – типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может быть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислителя при взаимодействии с простыми веществами – восстановителями (металлами, водородом, некоторыми неметаллами имеющими меньшую ЭО). Восстановителем сера является по отношению к более сильным окислителям (кислороду, галогенам и кислотам – окислителям).
Взаимодействие серы с простыми веществами

Сера реагирует как окислитель:
Источник
H2S + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме H2S + H2O = ? Охарактеризуйте химическое соединение сероводород: укажите его основные физические и химические свойства, а также способы получения.
Сероводород в обычных условиях представляет собой бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха и горит голубоватым пламенем, образуя диоксид серы и воду:
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Очень ядовит. При 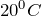
Сероводород – сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
В лабораторных условиях для получения сероводорода наиболее часто используют следующие реакции:
— действие разбавленных растворов кислот на сульфиды
— взаимодействие сульфида алюминия с водой
Пожалуйста, зарегистрируйтесь или войдите, чтобы добавить ответ.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Источник
H2S + Cl2 + H2O = ? уравнение реакции
Здесь есть кто-нибудь, кто хорошо разбирается в химии? Мне нужна помощь: какие продукты образуются в результате взаимодействия сероводорода, хлора и воды (H2S + Cl2 + H2O = ?). Укажите основные физические и химические свойства одного из продуктов реакции.
В результате взаимодействия сероводорода с хлором в воде (H2S + Cl2 + H2O = ?) происходит образование серной кислоты и хлороводорода. Молекулярное уравнение реакции имеет вид:
Записать ионные уравнения в данном случае не предоставляется возможным, поскольку реакция протекает не в растворе, а в газовой фазе.
Безводная серная кислота представляет собой тяжелую, вязкую жидкость, которая легко смешивается с водой в любой пропорции взаимодействие характеризуется исключительно большим экзотермическим эффектом (
880 кДж/моль при бесконечном разбавлении) и может привести к взрывному вскипанию и разбрызгиванию смеси, если воду добавлять к кислоте; поэтому так важно всегда использовать обратный порядок в приготовлении растворов и добавлять кислоту в воду, медленно и при перемешивании.
Серная кислота – сильная двухосновная кислота. Она образует два ряда солей: средние – сульфаты и кислые — гидросульфаты.
Концентрированная серная кислота, особенно горячая, — энергичный окислитель. Она окисляет HI и HBr (но не HCl) до свободных галогенов, уголь – до 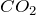
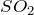
Серная кислота вступает в реакции обмена, нейтрализуется щелочами. Безводная 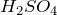
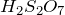
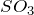
Источник