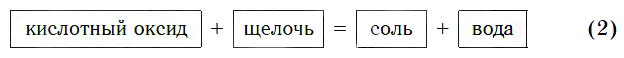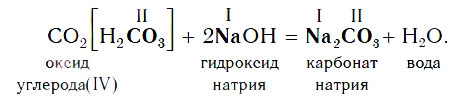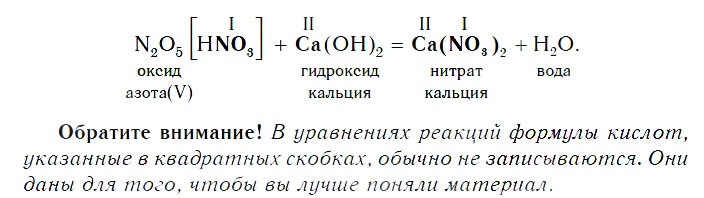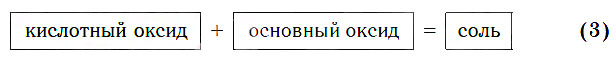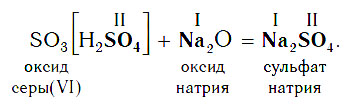- Химические свойства кислотных оксидов
- Урок 32. Химические свойства оксидов
- 1. Химические свойства кислотных оксидов
- 2. Химические свойства основных оксидов
- Опыты по химии. Оксиды
- Все химические реакции, которые необходимы для успешной сдачи ОГЭ
- Правило 9. Химические свойства оксидов
- Взаимодействие оксидов с водой
- Взаимодействие оксидов друг с другом
- Взаимодействие оксидов с кислотами
- Взаимодействие оксидов с основаниями
- Взаимодействие оксидов с солями
- Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с основными оксидами и основаниями с образованием солей.
При этом действует правило — хотя бы одному из оксидов должен соответствовать сильный гидроксид (кислота или щелочь).
Кислотные оксиды сильных и растворимых кислот взаимодействуют с любыми основными оксидами и основаниями:
Кислотные оксиды нерастворимых в воде и неустойчивых или летучих кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами. При этом возможно образование кислых и основных солей, в зависимости от соотношения и состава реагентов.
Например , оксид натрия взаимодействует с оксидом углерода (IV), а оксид меди (II), которому соответствует нерастворимое основание Cu(OH)2 — практически не взаимодействует с оксидом углерода (IV):
CuO + CO2 ≠
2. Кислотные оксиды взаимодействуют с водой с образованием кислот.
Исключение — оксид кремния, которому соответствует нерастворимая кремниевая кислота. Оксиды, которым соответствуют неустойчивые кислоты, как правило, реагируют с водой обратимо и в очень малой степени.
3. Кислотные оксиды взаимодействуют с амфотерными оксидами и гидроксидами с образованием соли или соли и воды.
Обратите внимание — с амфотерными оксидами и гидроксидами взаимодействуют, как правило, только оксиды сильных или средних кислот!
Например , ангидрид серной кислоты (оксид серы (VI)) взаимодействует с оксидом алюминия и гидроксидом алюминия с образованием соли — сульфата алюминия:
А вот оксид углерода (IV), которому соответствует слабая угольная кислота, с оксидом алюминия и гидроксидом алюминия уже не взаимодействует:
4. Кислотные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например , твердый оксид кремния SiO2 вытеснит более летучий углекислый газ из карбоната кальция при сплавлении:
5. Кислотные оксиды способны проявлять окислительные свойства.
Как правило, оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3 и др.). Сильные окислительные свойства проявляют и некоторые элементы с промежуточной степенью окисления (NO2 и др.).
6. Восстановительные свойства.
Восстановительные свойства, как правило, проявляют оксиды элементов в промежуточной степени окисления (CO, NO, SO2 и др.). При этом они окисляются до высшей или ближайшей устойчивой степени окисления.
Например , оксид серы (IV) окисляется кислородом до оксида серы (VI):
Источник
Урок 32. Химические свойства оксидов
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.
Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
1. Химические свойства кислотных оксидов
а) Взаимодействие с водой
Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:
Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами
Все кислотные оксиды реагируют со щелочами по общей схеме:
В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:
Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
в) Реакции с основными оксидами
Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
2. Химические свойства основных оксидов
а) Взаимодействие с водой
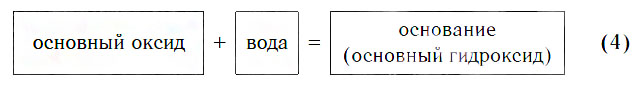
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:
К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
в) Взаимодействие с кислотными оксидами
Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.
- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Опыты по химии. Оксиды
Взаимодействие кислотных оксидов с водой
Возьмем оксид кремния SiO2 и оксид фосфора P2 O5. Это кислотные оксиды, потому что им соответствуют кислоты. Если кислотный оксид реагирует с водой, получается кислота.
Однако не всякий кислотный оксид способен реагировать с водой. Оксид фосфора и вода взаимодействуют, получается фосфорная кислота: лакмус краснеет в кислой среде.
P2 O5 + 3H2O = 2H3PO4
Фосфорный ангидрид (оксид фосфора V) — очень энергично притягивает влагу из атмосферы, поэтому его используют для осушения газов. Что происходит в пробирке с оксидом кремния? Оксид кремния — это обыкновенный песок. Даже при нагревании оксид кремния и вода не взаимодействуют – лакмус не изменяет цвета. Кислота не образуется.
Оборудование: шпатели, пробирки, штатив для пробирок, химический стакан, спиртовка.
Техника безопасности. Фосфорный ангидрид вызывает ожоги: необходимо избегать контакта кожи и слизистых оболочек с фосфорным ангидридом.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Взаимодействие основных оксидов с водой
Не всякий оксид реагирует с водой даже при нагревании. Это зависит от активности металла, образовавшего оксид. В пробирках — оксид кальция CaO, оксид железа Fe2O3, оксид меди CuO. Добавляем воду и нагреваем растворы.
Фенолфталеин укажет нам, в какой пробирке образовалась щелочь. Только оксид кальция прореагировал с водой — в пробирке фенолфталеин стал малиновым.
Активность металлов отражает ряд напряжений металлов.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Железо, и тем более медь — менее активны по сравнению с кальцием. С водой взаимодействуют только оксиды активных металлов.
Оборудование: шпатели, пробирки, штатив для пробирок, вода химический стакан, спиртовка.
Техника безопасности. Не допускать контакта оксида кальция с кожей и слизистыми оболочками. Следует соблюдать правила работы с нагревательными приборами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Источник
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 9. Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Основание | |
| Амфотерный оксид + H2O → реакция не идет | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |