Физические свойства кислорода
Где бы мы ни находились, нас всюду окружает кислород воздуха.
Почему же мы не замечаем и не чувствуем его? Кислород, азот, аргон и другие газы, входящие в состав воздуха, бесцветны и не имеют ни запаха, ни вкуса. Газообразный воздух нельзя ни видеть, ни ощущать.
Воздух из газообразного состояния можно перевести в жидкое. Одновременно с основной массой воздуха — азотом — в жидкое состояние перейдут кислород и большинство других газов, входящих в его состав.
Чтобы газообразный кислород превратить в жидкость, его нужно сжать до 50 атмосфер и охладить до —119°.
Жидкий кислород можно получить и при атмосферном давлении, но для этого нужно газообразный кислород охладить до температуры —183°. При более сильном охлаждении, до температуры —220°, жидкий кислород затвердевает и превращается в снегообразную массу.
Если на некоторое время в жидкий кислород поместить кусочек резины, она потеряет свою эластичность и под ударом разлетится на мелкие части.
Такую же хрупкость приобретает и цинковая пластинка, охлажденная в жидком кислороде до температуры —183°. Жидкая ртуть при такой температуре превращается в твердую массу, которую можно ковать, как свинец, а свинец приобретает способность звенеть, как бронзовый колокольчик.
Жидкий кислород имеет голубоватый цвет. Его можно легко переливать из сосуда в сосуд. При переливании жидкий кислород «парит». Но это не пары кислорода, а пары воды. Жидкий кислород, испаряясь, поглощает много тепла из окружающего воздуха. Воздух сильно охлаждается, и влага, находящаяся в воздухе, конденсируется, образуя туман. Этот туман и создает впечатление пара, исходящего из самой жидкости.
Температура кипения жидкого кислорода равна —183°.
Если фарфоровый стакан с жидким кислородом вынести зимой на мороз 30—40°, он будет кипеть более бурно, чем вода на самом сильном огне газовой плиты.
При комнатной температуре испарение жидкого кислорода идет еще энергичнее, и он быстро переходит в газообразное состояние.
Чтобы использовать жидкий кислород, его необходимо сохранить. Как же заставить эту бурно кипящую жидкость не так быстро испаряться?
Для этого служат специальные сосуды, в которых легко удается «укротить» эту быстро испаряющуюся жидкость.
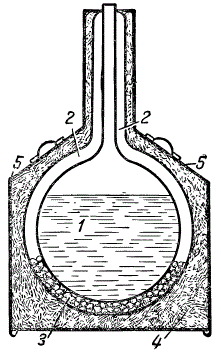
Стеклянный сосуд для хранения небольшого количества жидкого кислорода: 1 — жидкий кислород; 2 — разреженное пространство; 3 — поверхности, посеребренные внутри.
Сосуд для хранения жидкого кислорода представляет собой цилиндр с двойными стенками. Внутренние стороны стенок обычно покрывают тонким слоем серебра. Воздух между стенками сосуда выкачивается.
Разреженные газы плохо проводят тепло, а зеркальная поверхность серебра хорошо отражает его. Таким образом, жидкий кислород, который находится в сосуде, изолирован от внешнего тепла, что обеспечивает сохранение жидкого кислорода в течение одних-двух суток.
При испарении жидкого кислорода объем его увеличивается почти в 800 раз. Из кубического сантиметра жидкого кислорода образуется около 800 кубических сантиметров газообразного.
Хранить жидкий кислород в закрытых сосудах опасно: внутри сосуда может образоваться большое давление, приводящее к взрыву. Поэтому сосуды для хранения жидкого кислорода сверху открыты. Воздух, находящийся над жидкостью, сильно охлаждается и предохраняет кислород от наружного тепла, замедляя дальнейшее испарение.
Для перевозки небольших количеств жидкого кислорода используют металлические емкостью 15—25 литров.
Металлические сосуды состоят из двух шаров или цилиндров, вставленных друг в друга. Внутренний шар или цилиндр имеет высокое и узкое горло, через которое сосуд заполняется жидким кислородом. Горло всегда остается открытым. Из пространства между стенками сосуда воздух выкачан, и создан высокий вакуум, то есть сильное разрежение.
Металлический сосуд для перевозки жидкого кислорода: 1 — жидкий кислород; 2 — разреженное пространство; 3 — силикагель; 4 — теплоизоляционный материал; 5 — железный цилиндр.
Чтобы поддержать высокий вакуум, часть пространства между стенками заполняется силикагелем, способным при низкой температуре поглощать количество газа в сотни раз больше своего собственного объема. Если через стенки или через места спайки со временем просочится небольшая часть воздуха, он поглотится силикагелем и разрежение не уменьшится. Высокий вакуум обеспечивает постоянную изоляцию сосуда от внешнего тепла и дает возможность в течение двух и более суток сохранять в нем жидкий кислород. Такие сосуды обычно помещают в железные цилиндры.
Пространство между сосудом и наружным цилиндром заполняют теплоизоляционным материалом. Для переноски на наружном цилиндре имеются ручки.
Большие количества жидкого кислорода перевозятся по железной дороге и автотранспортом в специальных цистернах или танках. Они хорошо изолированы от внешнего тепла. Емкость транспортных танков различна: от 1 тысячи до 10 тысяч литров. Цистерны, в которых жидкий кислород перевозят по железной дороге, вмещают до нескольких десятков тонн.
Жидкий кислород можно получить из жидкого воздуха, который образуется при низких температурах и высоком давлении.
Высокое давление создают в машинах, которые называются компрессорами. Их приводят в движение электродвигатели.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Взаимодействие жидкого кислорода с водой
Физические свойства кислорода
Воздух — это сложная смесь около 15 различных газов. Содержание азота в воздухе составляет 78 % от объема воздуха, а кислорода — 21 %. Кроме того, в воздухе содержится небольшое количество аргона (0,9 %), углекислого газа (0,03 %), озона, водяного пара и других газов.
Для живых существ важнейшим компонентом воздуха является кислород, поскольку он поддерживает дыхание и горение.
При обычных условиях кислород — газ без цвета, вкуса и запаха. Толстый слой жидкого кислорода — светло-голубого цвета.
Кислород малорастворим в воде. Плотность газообразного кислорода немного больше плотности воздуха.
Для получения кислорода в лаборатории используют гидроген пероксид H2O2. Гидроген пероксид при обычных условиях разлагается, но очень медленно, даже если его подогреть на горелке. Но если в раствор гидроген пероксида внести щепотку манган(ГУ) оксида, то реакция протекает намного быстрее:
В данной реакции манган(^) оксид играет роль катализатора — вещества, которое изменяет скорость химической реакции, но в ней не расходуется.
♦ Реакция получения кислорода является примером реакции разложения.
Реакции разложения — это реакции, в которых из одного сложного вещества образуется несколько других веществ.
В общем виде уравнение реакции разложения можно записать следующим образом:
Химические свойства кислорода
Кислород — химически очень активное вещество. Он взаимодействует почти со всеми простыми веществами и со многими сложными. Множество реакций взаимодействия веществ с кислородом протекают с выделением теплоты и света, т. е. происходит горение.
При взаимодействии простых веществ с кислородом образуются оксиды:
♦ Во всех этих уравнениях в левой части записаны формулы двух веществ, а в правой части — одного вещества. Такие реакции называют реакциями соединения.
Реакции соединения — это реакции, в которых из двух простых или сложных веществ образуется одно сложное вещество.
В общем виде уравнение реакции соединения можно записать следующим образом:
Некоторые сложные вещества также способны гореть. В таких реакциях в большинстве случаев образуется несколько оксидов — оксидов тех элементов, которые входили в состав сложного вещества:
Физические свойства воды
Формула воды (гидроген оксида) — H2O. При комнатной температуре вода находится в жидком состоянии — это бесцветная жидкость, в толстом слое — бледно-голубая.
При атмосферном давлении и температуре 0 °С вода превращается в лед, а при 100 °С — кипит. Плотность воды — 1 г/см 1 (при 4 °С).
Чистая вода почти не проводит электрический ток и плохо проводит теплоту. Она имеет высокую теплоемкость, т. е. медленно нагревается и медленно остывает.
При замерзании вода расширяется, поскольку плотность льда меньше плотности жидкой воды.
Взаимодействие воды с кислотными и основными оксидами
Все кислотные оксиды (за исключением силиций(^) оксида SiO2) вступают в реакции соединения с водой с образованием кислот:
Поскольку гидраты основных оксидов являются основаниями, то при взаимодействии с водой эти оксиды должны образовывать основания. Но большинство основных оксидов с водой не взаимодействуют.
Обратите внимание! В реакцию с водой вступают только оксиды, гидраты которых являются щелочами, в частности:
1. Охарактеризуйте физические свойства кислорода и воды.
2. Почему лед всегда плавает на поверхности жидкой воды?
3. Какие реакции называют реакциями соединения? разложения?
4. Приведите уравнения реакций, характеризующие химические свойства кислорода.
5. Приведите уравнения реакций взаимодействия воды с кислотными и основными оксидами.
Задания для усвоения материала
1. Какие из данных оксидов взаимодействуют с водой? Составьте соответствующие уравнения реакций. 2 1
Источник
Что такое жидкий кислород: общая информация
Кислород – самый распространенный элемент на планете. Он присутствует в воде, земной коре, воздухе и в организмах живых существ, активно участвуя во многих обменных процессах. В природе он обычно существует в виде газа, а в промышленности часто используется в качестве жидкости. Как ведет себя жидкий кислород? Какими свойствами он обладает и где используется?
Газ кислород
Кислород – один из важнейших элементов на планете. Он участвует в процессе дыхания, в метаболизме живых организмов, а также в круговороте веществ в биосфере. Кроме того, он способствует гниению и разложению органических остатков.
В нормальных условиях он является бесцветным газом, который не имеет вкуса и запаха. Он тяжелее воздуха и с трудом растворяется в воде. В химическом плане он очень активен и способен образовывать соединения практически со всеми элементами.
В свободном состоянии в виде молекул О2, состоящих из двух атомов оксигена, он находится в атмосфере. Благодаря такому строению элемент также называется «дикислородом», но он может существовать и в других вариациях. При определенных условиях его атомы могут образовывать «трикислород» с молекулой О3, которая представляет собой голубой газ озон со специфическим запахом.
В атмосфере содержание кислорода составляет примерно 21 % по массе, в земной коре его доля значительно выше и составляет около 47 % по массе. Элемент входит в состав более полутора тысяч разнообразных пород и минералов, большая часть из которых являются силикатами. Там он присутствует в виде соединений. В воде его содержание доходит до 85 %, и это не удивительно, ведь атомы оксигена и образуют воду вместе с элементом гидрогеном.
Жидкий кислород
Как и другие вещества, кислород может пребывать в различных агрегатных состояниях. Чтобы превратить газ в твердое тело или жидкость, его нужно сильно охладить. При давлении в 51 атмосферу он становится жидким уже при -119 °C. При нормальном давлении превращение происходит только при -183 °C. Охлаждаясь до температуры -220 °C, он затвердевает, образуя светло-голубые снегоподобные кристаллы.
В жидком состоянии кислород окрашивается в голубой оттенок и усиливает некоторые свойства газообразного вещества. Так, он ведет себя более агрессивно в химических реакциях, а также становится сильным парамагнетиком и может притягиваться магнитом.
Он закипает только при -183 °C, а плавится при +219 °C. Благодаря устойчивости к столь низким температурам жидкий кислород обладает криогенными свойствами и может использоваться в качестве хладагента. В нормальных условиях он быстро испаряется, превращаясь в газ. При этом он усиленно поглощает тепло и охлаждает окружающий воздух, отчего рядом с ним появляется ореол тумана. Во время испарения объем кислорода увеличивает в несколько сотен раз. Так, 1 см 3 жидкости образует почти 800 см 3 газа.
Химические свойства
Газообразный кислород является окислителем. Сам по себе он негорюч, но хорошо поддерживает процесс горения, а при значительной концентрации и высоких температурах является взрывоопасным.
С активными веществами (например, щелочными металлами) он может вступать в реакции даже при комнатной температуре и при обыкновенной концентрации в воздухе, образуя с ними соединения оксиды. Результат хорошо виден на многих металлах, на которых он проявляется в виде коррозии.
Жидкий кислород также обладает сильными окислительными свойствами. Многие пропитанные им вещества легко воспламеняются и горят с выделением энергии и тепла. Хлопок, бумага, дерево, уголь и некоторые другие материалы могут взрываться.
Получение
Самым распространенным и легким в получении источником кислорода является воздух. К тому же он неиссякаем и присутствует в нашей жизни повсеместно. Чтобы получить из него необходимые вещества, его сжижают, а затем разделяют на жидкий азот и кислород.
Еще один способ получения жидкости – конденсация ее из газа. Для этого достаточно опустить медный змеевик в контейнер с жидким азотом, а затем пропустить через змеевик газообразный кислород. Температура азота ниже, чем у кислорода, поэтому, проходя по медной трубке, газ будет конденсироваться и превратится в жидкость. При этом на поверхности змеевика образуется небольшой слой снега.
Применение
Способность жидкого кислорода окислять другие вещества и усиливать горение ценятся во многих сферах производства. В конце XIX – середине XX века из него изготавливали взрывчатку «Оксиликвит», которую использовали в горной промышленности для подрыва породы, а также в качестве оружия во Второй мировой войне.
Сегодня его чаще применяют в медицине, фармацевтике, в металлургии, стекольной, химической, бумажной и других видах промышленности. С его помощью получают различные полезные соединения, например окись титана, которая участвует в производстве лакокрасочных изделий, бумаги и пластмасс. При изготовлении стекла он нужен для поддержания жара в печах, а также для уменьшения количества окиси азота, попадающей в атмосферу. В космической авиации жидкий кислород является одним из компонентов ракетного топлива, где он используется в качестве окислителя, а в роли самого топлива выступает водород или керосин.
В медицине и фармацевтике без него тоже не обходится. Жидкий кислород входит в состав биореакторов, а также используется в качестве добавки к ферментам. В медицине он необходим для анестезии, приготовления кислородных ванн и коктейлей, лечения или облегчения состояния при интоксикации, астме и других недугах. Здесь он чаще всего не используется напрямую в виде жидкости, а является источником газообразного кислорода.
Хранение и меры предосторожности
Жидкий кислород не возгорается и не взрывается сам по себе, он не токсичен для человека и не вреден для окружающей среды. Однако активная реакция в химических процессах, а также криогенный эффект делают его не совсем безопасным веществом.
При работе с ним нужно держать подальше смазочные, горючие и легковоспламеняющиеся материалы, а также всегда использовать перчатки и спецодежду. Кислород очень низкой температуры легко повреждает кожу и может привести к обморожению, травмам и отмиранию живых клеток. Если жидкость покрывает значительную часть тела, все может закончиться даже летальным исходом.
Технический и медицинский жидкий кислород хранят сосудах Дьюара, которые делают преимущественно из стали или алюминия. Это цилиндрические контейнеры с двойными стенками, между стенками которых располагается вакуумная полость, а также теплоизоляционные материалы. Они работают по принципу термосов, хорошо сохраняя жидкости внутри.
Источник