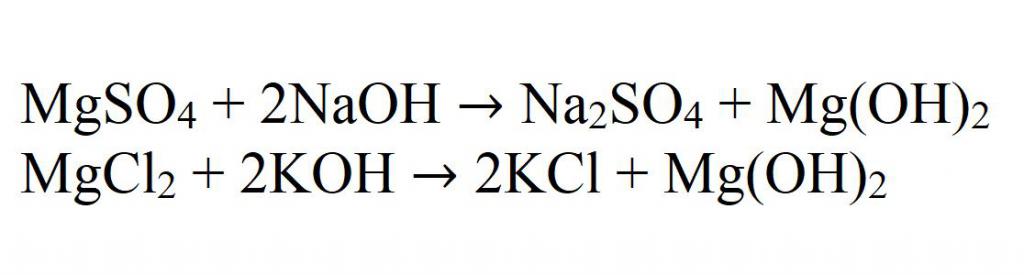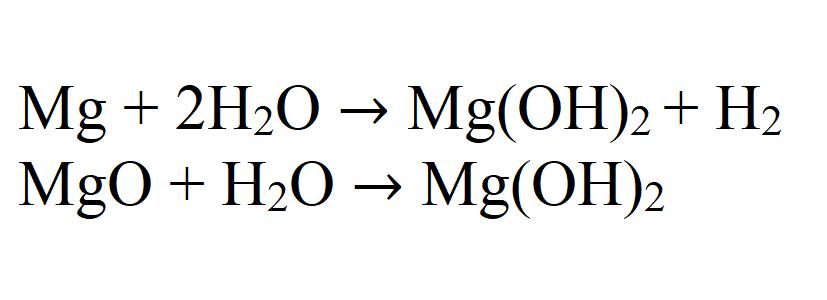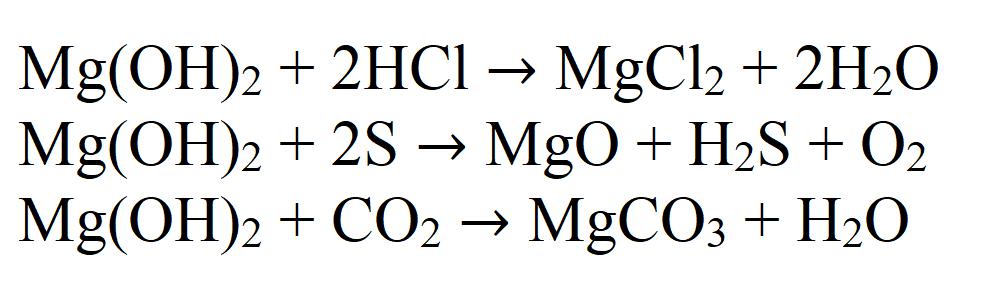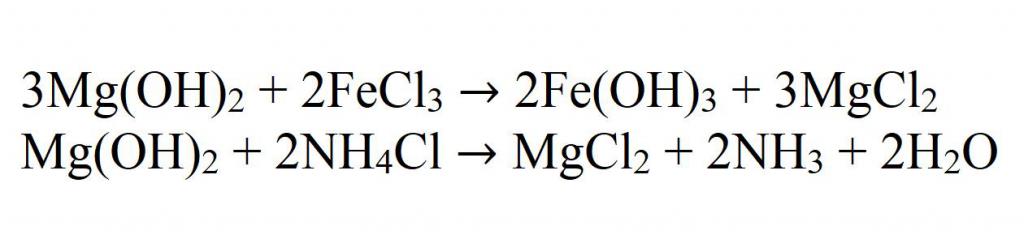- Гидроксид магния: способы получения и химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
- Гидроксид магния: описание вещества, свойства и применение
- Распространение в природе
- Получение
- Физические свойства
- Химические свойства
- Применение в медицине
- Применение в других отраслях
- Гидроксид магния, характеристика, свойства и получение, химические реакции
- Гидроксид магния, характеристика, свойства и получение, химические реакции.
- Краткая характеристика гидроксида магния:
- Физические свойства гидроксида магния:
- Получение гидроксида магния:
- Химические свойства гидроксида магния. Химические реакции гидроксида магния:
- Применение и использование гидроксида магния:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
Гидроксид магния: способы получения и химические свойства
Гидроксид магния Mg(OH)2 — неорганическое соединение. Белый, при нагревании разлагается. Не растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 58,32; относительная плотность для тв. и ж. состояния d = 2,39.
Способы получения
1. Гидроксид магния получают в результате взаимодействия хлорида магния и разбавленного раствора гидроксида натрия, на выходе образуется хлорид натрия и гидроксид магния :
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
2 . При взаимодействии магния с горячей водой образуется гидроксид магния и водород:
3. Нитрат магния при взаимодействии с разбавленным раствором гидроксида натрия образует нитрат натрия и гидроксид магния:
4. Сульфат магния взаимодействует с разбавленным раствором гидроксида натрия, образуя гидроксид магния и сульфат натрия:
Качественная реакция
Качественная реакция на гидроксид магния — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид магния взаимодействует со сложными веществами :
1.1. Гидроксид магния реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом магния и разбавленной соляной кислотой образуется хлорид магния и вода:
1.2. Гидроксид магния взаимодействует с оксидами:
В результате взаимодействия твердого гидроксида магния и углекислого газа при комнатной температуре образуется гидроксокарбонат магния и вода:
1.3. Гидроксид магния реагирует с солями :
Гидроксид магния взаимодействует с концентрированным и горячим раствором хлорида аммония , образуя хлорид магния, аммиак и воду:
2. Гидроксид магния разлагается при температуре 350 — 480º С, образуя на выходе оксид магния и воду:
Источник
Гидроксид магния: описание вещества, свойства и применение
Гидроксид магния — это неорганическое вещество, оно является малорастворимым соединением, из-за чего при его образовании в водных растворах появляется осадок. Формула гидроксида магния — Mg(OH)2, то есть это двухкислотное основание. Более растворим в воде, чем типичные нерастворимые основания, но менее растворим, чем гидроксид кальция. По этой причине его относят к малорастворимым соединениям.
Распространение в природе
Гидроксид магния в природе встречается в виде минерала брусита. Крупные месторождения этой породы — большая редкость. В России его добывают на Кульдурском месторождении, где его запасы оценивают в 14 миллионов тонн. Добыча на нем идет со скоростью примерно в 250 тысяч тонн продукта в год, но с этого года объемы добычи увеличились вдвое. Причиной этому стал хороший спрос на этот минерал за границей. Самым крупным импортером является Япония.
Выглядит брусит как белые, серые или зеленовато-белые кристаллы со стеклянным блеском на изломе. Имеет довольно низкую твердость, поэтому легко режется ножом. Может содержать примеси. В зависимости от их количества и типа выделяют несколько подвидов этого минерала. Так, ферронемалит содержит в себе, помимо гидроксида магния, 5 % железа в виде оксида, а ферробрусит — уже целых 36 %. Оксид железа имеет бурый цвет (цвет ржавчины), поэтому эти минералы приобретают тот же оттенок вместо привычного светло-зеленого. Существует еще и мангобрусит. В качестве примеси здесь выступает марганец. Такой минерал имеет уже медово-желтый цвет. Но при контакте с кислородом воздуха минерал быстро теряет свой красивый цвет и быстро чернеет.
Применяют данный минерал в основном как сырье. Из него получают оксид и другие соединения магния, флюсы, различные огнеупорные материалы. Но брусит можно применять и без какой-либо обработки. Так, этот минерал используют для очистки газов от хлора и для сорбционного фильтрования воды.
Получение
Основная реакция получения нерастворимых гидроксидов — это реакция взаимодействия щелочей с солями магния. Например, при взаимодействии сульфата магния с гидроксидом натрия. Это хорошая иллюстрация. А еще пример — при взаимодействии хлорида магния и гидроксида калия.
В ионном виде все подобные реакции записываются как:
При взаимодействии магния или его оксида с водой может также получаться гидроксид. Данная реакция идет очень медленно и только при нагревании.
Существует такой достаточно распространенный минерал — доломит. С химической точки зрения он представляет смесь карбоната кальция и магния. При обработке этого минерала водным раствором хлорида магния при нагревании в осадок выпадает нерастворимый гидроксид:
Физические свойства
В сухом виде гидроксид магния представляет собой белое кристаллическое вещество. Не имеет запаха, но ему присущ вкус щелочи. Он малорастворим в воде (всего 0,6 мг на 100 мл воды). Но даже несмотря на это, его водные растворы имеют слабощелочную среду и окрашивают индикаторы в соответствующие цвета. Зато данное соединение растворяется в растворах солей аммония. Оно не плавится, так как при температуре 480 o C разлагается на оксид магния и воду, как и любое другое нерастворимое основание. Плотность при нормальных условиях: 2,4 г/см 3 .
Химические свойства
Гидроксид магния — типичное нерастворимое основание. Это и определяет его химические свойства. Так, например, реагирует гидроксид магния с кислотами, кислотными оксидами и неметаллами:
Из-за последней реакции он имеет склонность поглощать углекислый газ прямо из воздуха с образованием карбоната, поэтому хранить данное вещество длительное время открытым не рекомендуется.
Взаимодействует также и с солями, если в результате реакции получается осадок или газ:
Как уже было указано выше, при нагревании идет разложение гидроксида магния по уравнению:
Что касается образования комплексных соединений, где катион магния выступал бы в качестве лиганда, то на этот счет имеются противоречивые сведения. В одних источниках указывается, что магний не склонен к их образованию, и существуют лишь только неустойчивые соединения с галогенидами магния. В других источниках указывается, что гидроксид магния может реагировать с горячими щелочами с образованием гидромагнезатов:
Применение в медицине
В медицине суспензии на основе гидроксида магния используются как антацидное средство. Этому способствуют основные свойства. Попадая в желудок, гидроксид магния снижает его кислотность, нейтрализуя соляную кислоту. Применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки. Препараты на его основе не снижают кислотно-щелочное равновесие и не нарушают секрецию соляной кислоты. Но даже несмотря на это, препарат имеет ряд ограничений и противопоказан людям с гиперчувствительностью к гидроксиду магния.
Продуктом взаимодействия гидроксида магния и соляной кислоты желудочного сока является хлорид магния. Он является сильным слабительным (действие наступает через 2-6 часов). Поэтому гидроксид магния является активным компонентом некоторых препаратов этой области. Избыток магния в организме легко выводится почками, но если человек страдает какими-либо болезнями этих органов, то он может получить избыток магния в организме при приеме препаратов (гипермагнемия).
Еще одно свойство данного соединения — расслабление мускулатуры. Иногда препараты, содержащие гидроксид магния, прописывают женщинам с угрозой выкидыша.
Применение в других отраслях
Гидроксид магния применяется и в пищевой промышленности как добавка Е528. В продуктах он регулирует кислотность и стабилизирует цвет. Еще применяют гидроксид магния для связывания диоксида серы, появление которого нежелательно в пищевых продуктах. Применяют его при производстве консервированных овощей, соусов, маринада и сыра. Эта добавка считается безвредной, но она запрещена в Австралии, Великобритании и Новой Зеландии.
Также гидроксид магния применяется как огнезащитная добавка в полимеры (ПВХ, полиолефины), как добавка в моющие средства и зубные пасты, для рафинирования сахара и очистки сточных вод.
Получаемый из гидроксида магния оксид — довольно полезное соединение. Оно способно выдерживать температуру около 3000 градусов, поэтому его используют как огнеупор. Так, его добавляют в кирпичи, из которых потом делают доменные печи. Используют оксид магния и как сорбент для очистки нефтепродуктов. Абразивные способности данного соединения также высоки. С помощью него очищают и полируют поверхности деталей в электронной промышленности.
Источник
Гидроксид магния, характеристика, свойства и получение, химические реакции
Гидроксид магния, характеристика, свойства и получение, химические реакции.
Гидроксид магния – неорганическое вещество, имеет химическую формулу Mg(OH)2.
Краткая характеристика гидроксида магния:
Гидроксид магния – неорганическое вещество белого цвета.
Химическая формула гидроксида магния Mg(OH)2.
Практически нерастворим в воде. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию.
Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния.
Встречается в природе в виде минерала брусита.
Физические свойства гидроксида магния:
| Наименование параметра: | Значение: |
| Химическая формула | Mg(OH)2 |
| Синонимы и названия иностранном языке | magnesium hydroxide (англ.) |
брусит (рус.)
Получение гидроксида магния:
Гидроксид магния получают в результате следующих химических реакций:
- 1. в результате взаимодействия металлического магния с парами воды:
- 2. в результате взаимодействия оксида магния и воды:
- 3. в результате взаимодействия растворимых солей магния с щелочью:
При этом гидроксид магния выпадает в виде осадка.
- 4. в результате взаимодействия хлорида магния с обожженным доломитом:
При этом гидроксид магния выпадает в виде осадка.
Химические свойства гидроксида магния. Химические реакции гидроксида магния:
Гидроксид магния является основным основанием, т. е. обладает основными свойствами.
Гидроксид магния – слабое малорастворимое основание.
Химические свойства гидроксида магния аналогичны свойствам гидроксидов других основных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида магния с гидроксидом натрия:
В результате реакции образуется тетрагидроксомагнезиат натрия. В ходе реакции используется насыщенный раствор гидроксида натрия .
2. реакция гидроксида магния с угольной кислотой:
В результате реакции образуются карбонат магния и вода .
3. реакция гидроксида магния с ортофосфорной кислотой:
В результате реакции образуются в первом случае – дигидроортофосфат магния и вода , во втором – гидроортофосфат магния и вода, в третьем – ортофосфат магния и вода.
4. реакция гидроксида магния с азотной кислотой:
В результате реакции образуются нитрат магния и вода .
Аналогично проходят реакции гидроксида магния и с другими кислотами.
5. реакция гидроксида магния с фтороводородом:
В результате реакции образуются фторид магния и вода.
6. реакция гидроксида магния с бромоводородом:
В результате реакции образуются бромид магния и вода .
7. реакция гидроксида магния с йодоводородом:
В результате реакции образуются йодид магния и вода .
8. реакция термического разложения гидроксида магния:
В результате реакции образуются оксид магния и вода.
9. реакция гидроксида магния с пероксидом водорода:
H2O2 + Mg(OH)2 → MgO2 + 2H2O (t вода . В ходе реакции используется концентрированный раствор пероксида водорода .
10. реакция гидроксида магния с оксидом серы:
В результате реакции образуются сульфат магния и вода .
11. реакция гидроксида магния с оксидом углерода:
В результате реакции образуется гидрокарбонат магния. В ходе реакции гидроксид магния используется в виде суспензии.
12. реакция гидроксида магния с оксидом углерода:
В результате реакции образуются нитрат магния и азотная кислота.
Применение и использование гидроксида магния:
Гидроксид магния используется при очистке воды (как флокулянт), в моющих средствах (как добавка), в качестве наполнителя в зубной пасте, для рафинирования сахара , в качестве пищевой добавки (Е528).
Примечание: © Фото //www.pexels.com, //pixabay.com

гидроксид магния реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения реакции масса взаимодействие гидроксида магния
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 485)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 494)
- Метан, получение, свойства, химические реакции (23 738)
- Этилен (этен), получение, свойства, химические реакции (22 835)
- Природный газ, свойства, химический состав, добыча и применение (21 172)
- Крахмал, свойства, получение и применение (20 577)
- Целлюлоза, свойства, получение и применение (19 433)
- Пропилен (пропен), получение, свойства, химические реакции (19 114)
- Прямоугольный треугольник, свойства, признаки и формулы (18 734)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник