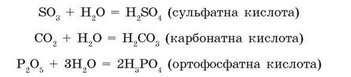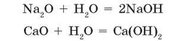ГДЗ (відповіді) Хімія 7 клас Григорович О.В., 2015 §24 ВЗАЄМОДІЯ ОКСИДІВ З ВОДОЮ
Контрольні запитання
1. Які оксиди називають кислотними, а які — оснóвними? Оксиди, гідрати яких є кислотами, називають кислотними оксидами. Оксиди, гідрати яких є основами, називають оснóвними оксидами.
2. Які речовини називають гідратами? Речовини, що утворюються сполученням води з іншими речовинами, називають гідратами.
3. Які кислотні оксиди за звичайних умов взаємодіють з водою, а які — ні? Усі кислотні оксиди, окрім силіцій (IV) оксиду SiО2
Які з оснóвних оксидів здатні взаємодіяти з водою? Оснóвні о ксиди, гідрати яких розчиняються у воді, тобто є лугами.
Завдання для засвоєння матеріалу
Вправа 1. Як можна добути з кислотного оксиду кислоту? Реакцією сполучення кислотного оксиду з водою, окрім SiO2.
Наведіть рівняння реакцій кислотних і оснóвних оксидів з водою.
Рівняння ре акцій кислотних оксидів з водою:
Рівняння ре акцій оснóвних оксидів з водою:
K 2 O + H 2 O = 2KOH (калій гідроксид)
Li2O + H2O = 2LiOH (літій гідроксид)
BaO + H2O = Ba(OH)2 (барій гідроксид)
CaO + H2O = Ca(OH)2 (кальцій гідроксид)
Вправа 2. Із наведеного переліку випишіть в окремі стовпчики формули оксидів:
Вправа 3. Які з наведених оксидів Na2 O, CO2 , SO3 , CrО, SiО2 взаємодіють із водою? Na2 O, CO2 , SO3
Складіть відповідні рів няння реакцій.
Na2O + H2O = 2NaOH (натрій гідроксид)
Вправа 4. Розчин, що утворився при розчиненні газуватого оксиду у воді, за барвлює лакмус у червоний колір. Який це газ міг бути? Лакмус у червоний колір забарвлює розчин кислоти, а кислота утворюється внаслідок взаємодії з водою кислотного оксиду, наприклад, с ульфур (IV) оксид SO2
Вправа 5. Гасіння вапна — це взаємодія негашеного вапна (кальцій оксиду) з во дою. Складіть рівняння цієї реакції.
Вправа 6. Як ви вважаєте, чи можна знайти в природних умовах фосфор (V) оксид, сульфур (VI) оксид та натрій оксид? Відповідь поясніть. Ні, бо ці оксиди є хімічно активними і за звичайних умов реагують з водою утворюючи кислоти (H3PO4, H2SO3) чи луг (NaOH), що реагують з утворенням відповідних солей.
Вправа 7. Доповніть схеми реакцій і назвіть продукти реакції:
а) Li2 O + H2 O = 2LiOH — літій гідроксид
в) BaO + H2 O = Ba(OH)2 — барій гідроксид
Вправа 8. Деякі оксиди використовують як осушувачі для зневоднення газів та деяких неводних рідин. На якому принципі ґрунтується дія оксидів як осушувачів? На здатності деяких оксидів взаємодіяти з водою, але не взаємодіяти з газом чи рідиною, що містить воду як домішку.
Які оксиди можна так використовувати і чому саме їх? Ф осфор (V) оксид P2 O5 можна використати для осушування сірководню (H2S), сірковуглецю (CS2), метану (CH4) і зневоднення кислот. Кальцій оксид СаО можна використати для осушення благородних газів і зневоднення спиртів.
Источник
Які оксиди взаємодіють з водою
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімічні властивості оксидів: взаємодія з водою, кислотами
Хімічні властивості. За хімічними властивостями оксиди поділяють на солетворні та несолетворні, або байдужі. Несолетворних оксидів дуже мало, це — CO, SiO, NO, N20. Вони не утворюють солей.
Оксиди за складом класифікують на оксиди металів і оксиди неметалів. Дізнаємося, як вони ставляться до води.
Дослід 1. У порцелянову чашку поміщаємо грудочки свіжопрожареного кальцій оксиду СаО (негашене вапно) і доливаємо до нього води (мал. 3). Спостерігається таке сильне розігрівання, що частина води перетворюється на пару, а грудочки розсипаються, перетворюючись на сухий пухкий порошок — гашене вапно, або кальцій гідроксид Са(ОН)2. Виділення теплоти засвідчує, що відбулася реакція. Запиши рівняння цієї реакції:
СаО + Н20 = Са(ОН)2
Мал. 3. Гашення вапна
• Пригадай, як називаються реакції, що відбуваються з виділенням теплоти.
Так само, як кальцій оксид, сполучаються з водою й оксиди інших активних металів, наприклад оксиди Натрію, Літію, Барію:
Na20 + Н20 = 2NaOH
Натрій гідроксид
Li20 + Н20 = 2LiOH
Літій гідроксид
ВаО + Н20 = Ва(ОН)2
Барій гідроксид
Приклади оксидів металів, що взаємодіють з водою:
натрій оксид Na20
літій оксид Li20
барій оксид ВаО
кальцій оксид СаО
Гідроксиди металів називають основами. Основи, як і оксиди, утворюють клас неорганічних сполук.
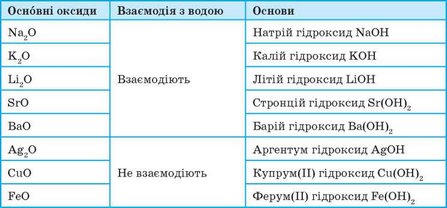
Не всі оксиди металів безпосередньо реагують з водою. Більшість із них, наприклад CuO, Fe2O3, Аl2O3, з водою не взаємодіє. То, може, відповідні цим оксидам гідроксиди (основи) не існують? Існують, але їх добувають непрямим шляхом, як саме — дізнаєшся далі. А поки що зверни увагу на формули гідроксидів металів, що відповідають оксидам:
Оксиди металів, що не взаємодіють з водою
CuO — купрум(ІІ) оксид
Fe2O3 — ферум(ІІІ) оксид
Аl2O3 — алюміній оксид
Нерозчинні основи — гідроксиди металів
Сu(ОН)2 — купрум(ІІ) гідроксид
Fe(OH)3 — ферум(ІІІ) гідроксид
Аl(ОН)3 — алюміній гідроксид
Zn(OH)2 — цинк гідроксид
Приклади оксидів металів, що не взаємодіють з водою:
плюмбум(ІІ) оксид РЬО
хром(ІІ) оксид СrO
манган(ІІ) оксид МnО
ферум(ІІ) оксид FeO
Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними.
Усі основні оксиди за стандартних умов — тверді речовини.
Дослід 2. У порцелянову чашку поміщаємо фосфор(V) оксид і додаємо води. Реакція також екзотермічна. Суміш розігрівається так, що вода закипає. Утворюється нова речовина — фосфатна, або ор-тофосфатна, кислота. Якщо вода холодна, то утворюється метафосфатна кислота:
Р205 + Н20 = 2НР03
холодна Метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча Ортофосфатна кислота
Під час взаємодії з водою багатьох оксидів неметалів, наприклад карбон(IV) оксиду С02 або сульфур(VI) оксиду SO3, також утворюються кислоти. Кислоти — це також певний клас неорганічних сполук:
CO2 + H2O = H2CO3
Карбонатна кислота
SO3 + Н2O = H2SO4
Сульфатна кислота
• До якого типу належать розглянуті реакції взаємодії оксидів металів і неметалів з водою?
Приклади оксидів неметалів, що взаємодіють з водою:
сульфур(ІV) оксид SO2
Під час взаємодії з водою багатьох оксидів неметалів утворюються кислоти.
Виникає запитання, чи всі оксиди неметалів розчиняються у воді, утворюючи кислоти? Ні, не всі. Наприклад, силіцій(IV) оксид Si02 (річковий пісок) у воді не розчиняється й кислоти у такий спосіб не утворює. Але це не означає, що силікатна кислота H2Si03 не існує. Вона так само, як і інші нерозчинні кислоти, що відповідають нерозчинним оксидам неметалів, може бути добута непрямим шляхом.
Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними.
Про інші хімічні властивості оксидів ти дізнаєшся пізніше.
ВИСНОВКИ
Оксиди активних металів взаємодіють з водою, утворюючи розчинні гідроксиди металів, або основи.
Оксиди металів, яким відповідають основи, називаються основними оксидами.
Оксиди неметалів взаємодіють з водою, утворюючи розчинні кислоти.
Оксиди неметалів, яким відповідають кислоти, називаються кислотними оксидами.
Кислотним і основним оксидам, що не розчиняються у воді, відповідають нерозчинні кислоти й нерозчинні основи. Кислотні й основні оксиди — солетворні.
Завдання для самоконтролю
1. Розстав коефіцієнти у таких схемах хімічних реакцій:
Na2O + Н2O → NaOH
Сl2O7 + Н2O → НСlО4
N2O5 + H2O → HN03
2. Які з наведених речовин можуть реагувати з водою: барій оксид, натрій оксид, сульфур(І\/) оксид, купрум(ІІ) оксид, силіцій(І\/) оксид, сульфур(\/І) оксид? Напиши рівняння реакцій.
3. Напиши рівняння реакцій, що відповідають таким перетворенням: а) Са → СаО → Са(ОН)2; б) С → С02 → Н2С03.
4. Обчисди масові частки елементів у натрій оксиді.
Додаткові завдання
5. Яку масу свинцевої руди треба взяти для добування свинцю масою 10 т? Припускаємо, що домішок немає і руда являє собою чистий свинцевий блиск PbS.
6*. Визнач кількість речовини карбон(І\/) оксиду, необхідного для повної взаємодії з водою масою 1,8 г.
7*. Унаслідок спалювання металу масою 3 г утворився його оксид масою 4,2 г, в якому валентність атома металу 2. Який це метал?
8*. Виведи формулу одного з оксидів Мангану, якщо відомо, що співвідношення маси Мангану в ньому до маси Оксигену становить 1:1.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Хімія 8 клас онлайн, підручники по всім предметам, плани уроків з хімії
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Источник
Які оксиди взаємодіють з водою
Поняття про кислоти й основи
Більшість оксидів здатні вступати в хімічні реакції з водою. Зазвичай ці реакції є реакціями сполучення, у результаті яких утворюються продукти приєднання води до оксидів. Речовини, що утворюються сполученням води з іншими речовинами, називають гідратами.
Залежно від того, з яким оксидом взаємодіє вода, може утворитися два типи гідратів: кислоти і основи. Кислоти складаються з атомів Гідрогену і кислотного залишку (H2SO4, Н2С03), а у формулах основ на першому місці записують металічний елемент, з яким сполучається гідроксильна група —ОН (KOH, Ba(OH)2). Залежно від гідрату, що відповідає певному оксиду, серед оксидів виділяють дві групи: кислотні оксиди та основні оксиди.
Усі кислотні оксиди, за винятком силіцій(ГУ) оксиду SiО2, за звичайних умов вступають у реакції сполучення з водою з утворенням кислот:
Оксиди, гідрати яких є кислотами, називають кислотними оксидами.
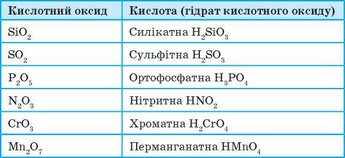
Більшість кислотних оксидів — це оксиди неметалічних елементів. Але кислотні оксиди можуть утворювати і металічні елементи, якщо ці елементи можуть виявляти високі валентності, вищі за чотири. Так, до кислотних оксидів належать хром(УІ) оксид Сг03 та манган(УІІ) оксид Мп207.
Формули найбільш поширених кислотних оксидів та відповідних їм кислот наведено в таблиці 5.
Таблиця 5. Кислотні оксиди та відповідні їм кислоти
Продукти реакції оксидів із водою (гідрати) можуть виявляти основні властивості. Якщо гідрат оксиду є основою, то такий оксид є основним.
Оксиди, гідрати яких є основами, називають основними оксидами.
До основних оксидів належать оксиди металічних елементів. Це здебільшого оксиди одно-, дво-, а іноді тривалентних металічних елементів (табл. 6).
Таблиця 6. Основні оксиди та відповідні їм основи
Більшість основних оксидів із водою не взаємодіють. У реакцію з водою вступають лише оксиди, гідрати яких розчиняються у воді (див. табл 6, с. 161). Такі гідрати називають лугами:
Єдиний кислотний оксид, що за звичайних умов не взаємодіє з водою, — це силіцій(^) оксид SiO2, якому відповідає силікатна кислота H2SiO3. Він дуже поширений у природі у складі мінералу кварцу. Звичайний кварцовий пісок на берегах морів і річок — це і є силіцій(^) оксид.
При взаємодії кальцій оксиду (негашеного вапна) з водою утворюється кальцій гідроксид (гашене вапно). Під час цієї реакції з водою виділяється настільки багато теплоти, що вода може закипіти. Цю реакцію використовують у так званих хімічних грілках для розігрівання сніданків або напоїв в одноразових пакетах.
Виявлення кислот і основ у розчинах
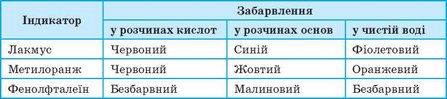
Більшість оксидів і відповідних їм гідратів — безбарвні сполуки, тому визначити їх наявність або розрізнити кислоти й основи без «сторонньої допомоги» неможливо. Для виявлення кислот і основ у розчинах використовують індикатори — складні органічні сполуки, що змінюють своє забарвлення залежно від наявності кислоти або основи в розчині (мал. 114). Найпоширеніші індикатори та їхній колір за наявності кислот та основ наведено в таблиці 7.
Таблиця 7. Забарвлення деяких індикаторів за наявності кислот і основ та у воді
Здебільшого індикатори використовують у вигляді розчинів — у воді або в спирті. Зручніше використовувати індикаторний папір — звичайний папір, просочений розчином індикатору, а потім висушений. У продаж він потрапляє у вигляді набору тоненьких смужечок (мал. 115).
ЛАБОРАТОРНИЙ ДОСЛІД № 5
Випробування водних розчинів кислот і лугів індикаторами
Обладнання: штатив із пробірками.
Реактиви: розчини основи, кислоти, вода, метилоранж, фенолфталеїн, лакмус.
• використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі.
1. Підготуйте по три пробірки з водою, розчином кислоти та розчином основи.
2. У першу пробірку з водою додайте кілька крапель розчину метилоранжу, у другу — лакмусу, у третю — фенолфталеїну.
3. Так само додайте індикатори в пробірки з розчинами кислоти й основи.
4. Порівняйте забарвлення індикаторів у різних пробірках і запишіть результати в зошит.
5. Зробіть висновок щодо виявлення кислот і основ індикаторами.
1. Оксиди здатні сполучатися з водою з утворенням гідратів. Гідрати кислотних оксидів — кислоти, а основних — основи.
2. До кислотних оксидів належать оксиди неметалічних елементів та оксиди металічних елементів із валентністю, вищою за IV. До основних оксидів належать оксиди металічних елементів із валентністю І, ІІ та іноді ІІІ.
3. Для виявлення кислот та основ у розчині використовують індикатори — речовини, забарвлення яких змінюється за наявності кислоти чи основи.
1. Які оксиди називають кислотними, а які — основними?
2. Які речовини називають гідратами?
3. Які кислотні оксиди за звичайних умов взаємодіють з водою, а які — ні? Які з основних оксидів здатні взаємодіяти з водою?
Завдання для засвоєння матеріалу
1. Як можна добути з кислотного оксиду кислоту? Наведіть рівняння реакцій кислотних і основних оксидів з водою.
2. Із наведеного переліку випишіть в окремі стовпчики формули оксидів: а) кислотних; б) основних. №20, Р205, С02, Б03, СгО, Си20, БІО2, Мп207.
3. Які з наведених оксидів взаємодіють із водою? Складіть відповідні рівняння реакцій. №20, С02, Б03, СгО, БІО2.
4. Розчин, що утворився при розчиненні газуватого оксиду у воді, забарвлює лакмус у червоний колір. Який це газ міг бути?
5. Гасіння вапна — це взаємодія негашеного вапна (кальцій оксиду) з водою. Складіть рівняння цієї реакції.
6. Як ви вважаєте, чи можна знайти в природних умовах фосфор(У) оксид, сульфур(УІ) оксид та натрій оксид? Відповідь поясніть.
7. Доповніть схеми реакцій і назвіть продукти реакції:
8*. Деякі оксиди використовують як осушувачі для зневоднення газів та деяких неводних рідин. На якому принципі ґрунтується дія оксидів як осушувачів? Які оксиди можна так використовувати і чому саме їх?
Источник