- Химия, Биология, подготовка к ГИА и ЕГЭ
- Качественные реакции органической химии
- Обесцвечивание бромной воды является качественной реакцией на. Бромную воду обесцвечивают оба вещества в ряду
- Примеры реакций обесцвечивания бромной воды
- Взаимодействие ацетилена с бромной водой
- Реакция ацетилена с раствором перманганата калия
- Реакция ацетилена с аммиачным раствором оксида серебра
- Лабораторный опыт №10 Химия 10 класс О.С.Габриелян Ответить на вопросы
- Подготовка к Основному государственному экзамену по химии. Задание А 17.
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества .
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 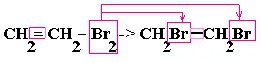 2. Изменение окраски раствора 2. Изменение окраски раствора 3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 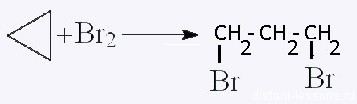 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 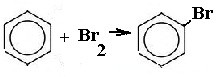
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 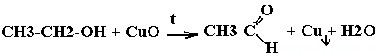 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 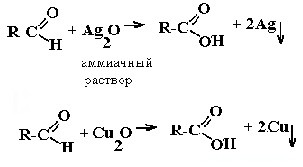 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Источник
Обесцвечивание бромной воды является качественной реакцией на. Бромную воду обесцвечивают оба вещества в ряду
Бром и бромную воду используют в медицине, строительстве, сельском хозяйстве и многих других сферах жизни человека.
Бромная вода представляет собой жидкость жёлто-оранжевого цвета, однако она обесцвечивается в ходе некоторых реакций. Почему так происходит? И какие вещества способны влиять на изменение её цвета?
Бромная вода представляет собой водный раствор брома. Она способна окислять металлы, а также ряд органических соединений. При реакции с соединениями, содержащими кратные связи, она обесцвечивается. Этот процесс представляет собой качественную реакцию на непредельность органических соединений. Исчезновение окраски раствора является доказательством непредельности.
Примеры реакций обесцвечивания бромной воды
При реакции бромной воды с алкинами и алкенами, полученный раствор обесцвечивается. Алкенам свойственна ненасыщенная двойная связь, а для алкинов – тройная связь, чем определяются их свойства. В ходе взаимодействия разрываются двойные и тройные связи, присоединяется бром. В результате образуются бромистые соединения. Алканы не обесцвечивают бромную воду.
Водный раствор брома также теряет цвет при взаимодействии с непредельными маслами, которые также имеют двойные и тройные связи.
При реакции йодистого калия и водного раствора брома, выводятся молекулы свободного йода, и происходит обесцвечивание раствора.
Для того, чтобы убедиться в приведенных примерах, достаточно простого смешивания указанных веществ в лабораторных условиях. Нагревание, воздействие света, участие катализаторов при этом не требуется. Такие эксперименты проводят во время обучения в школе и учреждениях профессионального образования, а вот проводить их в домашних условиях не стоит, так как бром токсичен и обладает сильным неприятным запахом.
Алкины (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp — гибридизации.
Взаимодействие ацетилена с бромной водой
Молекула ацетилена содержит тройную связь, бром разрушает её и присоединяется к ацетилену. Образуется терабромэтан. Бром расходуется на образование тетрабромэтана. Бромная вода (жёлтая) — обесцвечивается.
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
HC ≡ CH + Br 2 → CHBr = CHBr + Br 2 → CHBr 2 — CHBr 2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Обесцвечивание бромной воды доказывает непредельность ацетилена.
Реакция ацетилена с раствором перманганата калия
В растворе перманганата калия происходит окисление ацетилена, при этом происходит разрыв молекулы по месту тройной связи, раствор быстро обесцвечивается.
3НC ≡ СН + 10KMnO 4 + 2H 2 O → 6CO 2 + 10КОН + 10MnO 2
Эта реакция является качественной реакцией на двойную и тройную связь.
Реакция ацетилена с аммиачным раствором оксида серебра
Если ацетилен пропустить через аммиачный раствор оксида серебра, атомы водорода в молекуле ацетилена легко заместятся металлами, так как обладают большой подвижностью. В данном опыте атомы водорода замещаются атомами серебра. Образуется ацетиленид серебра — осадок жёлтого цвета (взрывоопасен).
CH ≡ СН + OH → AgC≡CAg↓ + NH 3 + H 2 O
Эта реакция является качественной реакцией на тройную связь.
3.Укажите соединение, содержащее карбоксильную группу:
1) ароматический спирт
4.Укажите соединение, содержащее карбонильную группу:
1) ароматический спирт
4) непредельная многоосновная кислота
5.Дайте название соединению: О
6. Реакция СН3СНО+Ag2O СН3СООН+2 Ag:
3) «серебряного зеркала»
7. Функциональная группа карбоновых кислот называется:
8. Уксусная кислота не реагирует со следующим металлом:
9. Как называется альдегид:
1) 2-Метил-3-пропилбутаналь;
2) 2,3-диметилгексаналь;
3) 4,5-диметилгексаналь;
4) 2-метил-2-пропилбутаналь
10. Укажите общую формулу углеводов:
11. Укажите углевод, являющийся основной частью древесины:
12. Укажите формулу фруктозы:
13.Пентоза, входящая в состав ДНК – это:
14. Молочный сахар – это дисахарид:
15. Свекловичный или тростниковый сахар – это дисахарид:
16. Солодовый сахар:
17. В клетках растений крахмал выполняет функцию:
1) Передачи наследственной информации
2) Запаса питательных веществ
3) Строительную и структурную
4) Катализатора биологических процессы
18. В клетках растений целлюлоза выполняет функцию:
1) Запаса питательных веществ
2) Катализатора биологических процессов
3) Строительную и структурную
4) Передачи наследственной информации
19. Дайте название соединению:
СН3 — СН – СН — СН3
1) 3-метилбутанол-2 3) 3-метилпропанон-2
2) 2-метилбутанол-3 4) 2 –метилпропаналь-2
20. Допишите уравнение химической реакции и дайте ей название:
1) гидратация 3) присоединения
2) реакция этерификации 4) замещения
Среди нижеперечисленных характеристик выберите те, которые, как правило, относятся к жидким жирам — маслам:
1) Имеют растительное происхождение
2) Имеют животное происхождение
3) Хорошо растворимы в воде
4) Хорошо растворимы в органических растворителях
7) Обесцвечивают бромную воду
8) Являются эфирами глицерина
Ответ дайте в виде последовательности цифр в порядке их возрастания.
В-2 Установите соответствие между характеристикой жира и примером жира, соответствующего этой характеристике. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту:
А) твердый жир растительного происхождения
Б) твердый жир животного происхождения
В)Жидкий жир животного происхождения
Г)Жидкий жир растительного происхождения
1) Льняное масло
2) Сливочное масло
4) Пальмовое масло
2) При растворении в воде 1 моль уксусного ангидрида образуется:
а) 2 моль этаналя
б) 2 моль этанола
в) 2 моль уксусной кислоты
г) 1 моль метилацетата
3) С какими веществами реагирует ацетат натрия:
а) Солярная кислота
б) Гидроксид натрия при нагреве
в) Угольная кислота
4) При взаимодействии этанола и оксида углерода (II) соответствующих условиях получается?
в) пропановая кислота
5) В реакции какого типа могут вступать непредельные карбоновые кислоты: а) Окисление
6) С какими веществами реагирует муравьиная кислота:
а) Хлорид меди II
б) Сульфат натрия
в) Гидрокарбонат калия
г) аммиачный раствор оксида серебра I
7) В отличие от стеариновой кислоты олеиновая кислота:
а) Жидкая при комнатной температуре
б) растворима в воде
в) Обесцвечивает бромную воду
г) Реагирует с щелочами
8) Какие вещества реагируют с водой:
а) линолевая кислота
9) С помощью какого одного реактива можно различить растворы глицерина, пропаналя, и этановой кислоты:
б) карбонат калия
в) гидроксид меди II
г) азотная кислота
10) В реакциях с какими веществами с участием уксусной кислоты от ее молекулы отщепляется гидросильная группа:
Источник
Лабораторный опыт №10 Химия 10 класс О.С.Габриелян Ответить на вопросы
Приветики) Сможете помочь с ответами по опыту. как-то расстерялась. что нужно отвечать((
1. В три пробирки налейте по 1 мл дистиллированной
воды, спирта и бензина и добавьте в них по 2—3 капли подсолнечного масла. Встряхните содержимое пробирок. В какой жидкости жиры растворяются лучше?
2. Несколько капель раствора жира в этиловом спирте и бензине нанесите на фильтровальную бумагу. Что наблюдаете после испарения растворителя?
3. Практически докажите, что в состав выданного вам растительного жира входят остатки непредельных кислот. Объясните свои действия.
Приветик. Смогу помочь по опыту, ответ не сложный, разберешься думаю, лови ответ 😉
1. В три пробирки налили по 1 мл дистиллированной воды, спирта и бензина. В каждую пробирку добавили по 2- 3 капли подсолнечного масла. Содержимое пробирок встряхнули. Наблюдаем различие растворимости подсолнечного масла в зависимости от растворителя. В пробирке с дистиллированной водой жидкости не смешались, происходит расслоение смеси. В пробирке со спиртом происходит частичное растворение подсолнечного масла. В пробирке с бензолом произошло полное растворение с образованием однородной смеси. Жиры лучше растворяются в неполярных растворителях.
2. На фильтровальную бумагу нанесли по несколько капель растворов жира в этиловом спирте и жира в бензоле. После испарения растворителя наблюдаем оставшиеся жирные пятна масла на фильтровальной бумаге.
3. В пробирку наливаем 2 мл растительного жира и добавляем несколько капель раствора перманганата калия. Наблюдаем обесцвечивание раствора перманганата калия. Обесцвечивание раствора перманганата калия является качественной реакцией на непредельные углеводороды.
Источник
Подготовка к Основному государственному экзамену по химии. Задание А 17.
Алканы- предельные ациклические УВ с общей формулой С n H 2 n +2 , в которых между атомами углерода существуют только простые сигма-связи.
Углеводородный радикал — это частица, которая образуется в результате потери углеводородом одного, двух или трёх атомов водорода. При этом образуются соответственно одно-, двух-, трёхвалентные радикалы.
Гомологи — это вещества, которые относятся к одному и тому же гомологическому ряду, имеют сходное строение , химические свойства
и отличаются друг от друга на одну или несколько гомологичных групп (-СН 2 -).
Изомеры -это вещества, которые имеют одну и ту же молекулярную формулу, но разное строение и свойства.
Газообразные алканы используются в качестве топлива. Жидкие алканы входят в состав продуктов переработки нефти( бензин, дизельное топливо, керосин), применяются в качестве растворителей. Вазелины, твёрдые парафины широко используются в медицине, парфюмерии(мази, кремы).
Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена прочностью и очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой ЭО(электроотрицательности) атомов углерода и водорода.
Для алканов наиболее характерны реакции замещения, проходящие по по свободному(цепному) механизму, разложения, изомеризации, окисления. В результате реакций замещения происходит разрыв С-Н связей.
1. Галогенирование( замещение атома водорода атомами галогена-С l , Br с образованием галогеналкана R — Cl )
2. Нитрование( взаимодействие с азотной кислотой, происходит замещение атома водорода нитрогруппой- NO 2 c образование нитроалканов R — NO 2 .
При обычных условиях алканы устойчивы к действию окислителей KMnO 4 , K 2 Cr 2 O 7 )
1) Окисление кислородом воздуха при высоких температурах( горение)
а) полное окисление( избыток кислорода) с образованием углекислого газа и воды
б) неполное окисление( недостаток кислорода) с образованием кокса/угарного газа и воды
4) Термические превращения алканов
1) Полный крекинг метана(пиролиз)
2)Неполный крекинг метана
3) Расщепление алканов с большим числом углеродных атомов происходит так, что связь между углеродными атомами разрывается примерно посередине, при этом образуется алкан и алкен.
Физические свойства алканов:
С 18 и выше- твёрдые вещества
Алканы — б/ц вещества, легче воды, плохо растворимы в полярных растворителях(воде), но хорошо растворимы в неполярных(бензоле).
Задания ОГЭ по теме Алканы
Для этана верны следующие утверждения:
1. Для этана верны следующие утверждения:
1) молекула содержит один атом углерода и четыре атома водорода
2) относительная молекулярная масса равна 30
3) является непредельным углеводородом
4) вступает в реакции замещения
5) обесцвечивает раствор
2.Для этана верны следующие утверждения:
1) имеет три атома углерода в молекуле
2) атомы углерода в молекуле соединены одинарной связью
3) хорошо растворим в воде
4) вступает с хлором в реакцию замещения
5) является негорючим веществом
3.Для метана верны следующие утверждения:
1) молекула содержит 4 атома водорода
2) является непредельным углеводородом
3) атом углерода в молекуле соединён с атомами водорода двойной связью
4) вступает в реакции присоединения с бромоводородом
5) вступает в реакцию замещения с хлором
4.Метан реагирует с
5) оксидом натрия
5.Какие утверждения относительно метана справедливы?
1) хорошо растворим в воде
2) при сгорании выделяется большое количество теплоты
3) вступает в реакции замещения
4) реагирует с водородом
5) проявляет кислотные свойства
6.Какие из утверждений относительно этана справедливы?
1) входит в состав природного газа
2) является непредельным углеводородом
3) атомов водорода в молекуле в 3 раза больше, чем атомов углерода
4) при обычных условиях представляет собой жидкость
5) хорошо растворяется в воде
7.Какие утверждения справедливы для метана?
1) хорошо растворяется в воде
2) является гомологом этилена
3) взаимодействует с хлором
4) взаимодействует с кислородом
5) имеет двойные связи в молекуле
8.Для метана верны следующие утверждения:
1) молекула содержит 2 атома углерода
2) является легковоспламеняющейся жидкостью (н.у.)
3) реагирует с активными металлами
4) образует с воздухом взрывоопасные смеси
5) не присоединяет водород
9.Для этана верны следующие утверждения:
1) молекула содержит четыре атома углерода
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены двойной связью
4) вступает в реакции разложения
5) вступает в реакцию с бромом
Алкены- это ациклические непредельные УВ с общей формулой С n H 2 n , содержащие одну двойную связь между атомами углерода.
С 17 Н 34 . -твёрдые вещества
Плохо растворимы в воде, однако растворимость лучше, чем у алканов, хорошо растворимы в органических растворителях.
Температура кипения и температура плавления алкенов ниже, чем у соответствующих алканов.
Для алканов характерны реакции присоединения, сопровождающиеся разрывом двойной связи.
1. Реакции присоединения
+ Hcl /+ HBr (гидрогалогенирование) по правилу Марковникова: При присоединении галогенводорода к алкену водород присоединяется к более гидрированномуатому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
+ H 2 O (гидратация), образуются предельные одноатомные спирты(алканолы)
2. Реакции окисления
а) Полное (горение) с избытком кислорода образуется углекислый газ и вода
б) Неполное( недостаток кислорода) угарный газ/кокс и вода
При действии разбавленного раствора перманганата калия ( KMnO 4 ) происходит обесцвечивание раствора ( реакция Вагнера)
малиновый цвет==> б/ц

3. Реакции полимеризации (открыты Бутлеровым)- процесс соединения одинаковых молекул( мономеров), протекающих за счёт разрыва кратных связей, с образованием высокомолекулярного соединения( полимера).
Задания ОГЭ по теме Алкены
1. Для этилена верны следующие утверждения:
1) относительная молекулярная масса равна 26
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены одинарной связью
4) вступает в реакции замещения
5) вступает в реакцию полимеризации
2. Для этилена верны следующие утверждения:
1) молекула содержит шесть атомов водорода
2) является предельным углеводородом
3) атомы углерода в молекуле соединены двойной связью
4) характерны реакции присоединения
5) разлагается с образованием углерода и метана
1) относится к непредельным углеводородам
2) не реагирует с кислородом
3) реагирует с водородом
4) имеет только одинарные связи
5) вступает в реакции замещения
4. И для этана, и для этилена характерны
1) реакции бромирования
2) наличие двойной связи в молекуле
3) реакции гидрирования
4) реакции с водой
5) горение на воздухе
1) хорошо растворим в воде
2) при обычных условиях представляет собой твёрдое вещество
3) молекула содержит двойную связь
4) является сильным окислителем
5) вступает в реакции присоединения
6. Для этилена верны следующие утверждения:
1) молекула описывается формулой
2) является предельным углеводородом
3) атомы углерода в молекуле соединены тройной связью
4) вступает с водой в реакцию присоединения
5) сгорает с образованием угарного газа и водорода
7.К акие утверждения справедливы для этилена?
1) белое вещество, хорошо растворимое в воде
2) является гомологом метана
3) обесцвечивает бромную воду
4) взаимодействует с кислородом
5) имеет тройную связь в молекуле
8. Для этилена верны следующие утверждения:
1) составу молекулы соответствует общая формула
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены одинарной связью
4) вступает в реакции присоединения
5) при горении образуется углерод и водород
Алкины — ациклические непредельные УВ с общей формулой С n H 2 n -2 , содержащие одну тройную связь между атомами углерода.
С 16 Н 30 (твёрдые вещества)
Плохо растворимы в воде.
Характерны реакции присоединения, полимеризации, изомеризации, замещения атомов водорода на металлы, окисления. Присоединение может происходить в 2 этапа: вначале образуются производные алкенов, а затем алканов. При избытке реагента реакция присоединения протекает по двум стадиям до конечных продуктов- производных алканов.
Ацетилен реагирует с образование ацетальдегида , остальные алкины образуют кетоны.
2. Реакции окисления
а)Горение(+О 2 полное окисление) с образованием углекислого газа и воды
б) Неполное окисление перманганатом калия( KMnO 4 )
Реакция с KMnO 4 является качественной реакцией на непредельные УВ, в том числе на алкины.
Ацетилен-представитель алкинов, имеющий наибольшее практическое значение. Он применяется в производстве высокомолекулярных соединений(синтетический каучук), является исходным сырьём в производстве уксусной кислоты и хлорсодержащих растворителей.
Задания ОГЭ по теме Алкины
1.Для ацетилена верны следующие утверждения:
1) состав молекулы соответствует общей формуле
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены двойной связью
4) вступает с водой в реакцию присоединения
5) сгорает с образованием углерода и водорода
2.Для ацетилена верны следующие утверждения:
1) состав молекулы отражает формула
2) является предельным углеводородом
3) атомы углерода в молекуле соединены тройной связью
4) вступает в реакции с хлороводородом
5) при горении образуются угарный газ и водород
3.Для ацетилена верны следующие утверждения:
1) молекула состоит из двух атомов углерода и четырёх атомов водорода
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены двойной связью
4) вступает в реакции с хлором
5) при разложении образуется углекислый газ и водород
4.С каждым из указанных веществ: хлороводород, водород, бромная вода — будет реагировать
5.Для ацетилена верны следующие утверждения:
1) состав молекулы соответствует общей формуле
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены двойной связью
4) реагирует с хлороводородом в присутствии катализатора
5) сгорает с образованием углерода и водорода
6.Для ацетилена верны следующие утверждения:
1) состав молекулы отражает формула
2) является предельным углеводородом
3) атомы углерода в молекуле соединены тройной связью
4) вступает в реакции с хлороводородом
5) при горении образуются угарный газ и водород
Спирты- производные УВ, молекулы которых содержат одну или несколько гидроксильных групп(ОН) с общей формулой C n H 2 n +1 OH
Для спиртов характерны реакции замещения, отщепления, окисления одноатомных и многоатомных спиртов.
Одноатомные спирты с растворами щелочей не реагируют. Качественной реакцией является окисление одноатомных спиртов нагретым оксидом меди ( II ).
Многоатомные спирты реагируют со щелочами с образованием соответствующих соединений металлов.
Химические свойства спиртов:
1) Спирты взаимодействуют с металлическим натрием, образуя соли с общим названием алкоголяты
2) Спирты вступают в реакцию дегидратации:
Межмолекулярная дегидратация приводит к образованию простых эфиров
3) Оксидом меди( II ) спирты окисляются в соответствующие альдегиды
4) С карбоновыми кислотами спирты вступают в реакцию этерификации, образуя при этом сложные эфиры
Метиловый спирт + уксусная кислота= метиловый эфир уксусной кислоты + вода
Физические свойства спиртов:
Глицерин — это представитель трёхатомного спирта. В отличие от двухатомного спирта этиленгликоля, глицерин не ядовит. Он неограниченно растворим в воде.
с характерным запахом, горит чуть голубоватым пламенем. Метанол(древесный спирт)- прекрасный растворитель, его используют для производства формальдегида, некоторых лекарственных веществ. !Метанол очень ядовит! Он является нервно-сосудистым ядом. При попадании в организм дозы в 30 мл и более -вызывает смерть.
Этанол( этиловый спирт)С 2 Н 5 ОН -бесцветная жидкость с характерным запахом, смешивается с водой в любых соотношениях. Промежуточный продукт окисления этанола в организме- ацетальдегид-ядовит и вызывает тяжелые отравления .

1) состав молекулы отражает общая формула
2) атомы углерода и водорода соединены ионной связью
3) плохо растворим в воде
4) вступает в реакцию присоединения с водородом
5) сгорает с образованием углекислого газа и воды
1) молекула содержит два атома углерода
2) является газообразным веществом (н. у.)
3) вступает в реакции с
4) реагирует с натрием
5) не вступает в реакции горения
1) относится к классу карбоновых кислот
2) молекула содержит восемь атомов водорода
3) между атомами углерода есть двойная связь
4) вступает в реакцию с водородом
5) вступает в реакцию с калием
1) в состав молекулы входит один атом углерода
2) атомы углерода в молекуле соединены двойной связью
3) является жидкостью (н. у.), хорошо растворимой в воде
4) вступает в реакцию с активными металлами
5) сгорает с образованием угарного газа и водорода
5. Для метилового спирта верны следующие утверждения:
1) является газообразным веществом (н. у.)
2) в молекуле имеется гидроксильная группа
4) плохо растворим в воде
5) вступает в реакцию с серебром
1) способностью к реакции полимеризации
2) присутствием в молекуле группы атомов
3) способностью к реакции с гидроксидом меди (II)
4) наличием двойной связи между атомами углерода и кислорода
5) реакциями с активными металлами
2) карбонатом натрия
4) гидроксидом меди(II)
1) состоит из двух элементов
2) при обычных условиях — газ тяжелее воздуха
3) хорошо растворим в воде
4) реагирует с щелочными металлами
5) является сильной кислотой
1) в состав молекулы входит один атом углерода
2) атомы углерода в молекуле соединены двойной связью
3) является жидкостью (н. у.), хорошо растворимой в воде
4) вступает в реакцию со щелочными металлами
5) сгорает с образованием угарного газа и водорода
10. Какие из утверждений относительно глицерина справедливы?
1) не растворяется в воде
2) при обычных условиях представляет собой твёрдое вещество
3) молекула содержит три атома кислорода
4) является сильной кислотой
5) взаимодействует с гидроксидом меди(II)
1) молекула содержит одну группу —
2) является нерастворимой в воде жидкостью
3) все атомы в молекуле соединены только одинарными связями
4) вступает в реакцию с натрием
5) горит с образованием угарного газа и водорода
Жиры- это смесь сложных эфиров глицерина и высших карбоновых кислот(ВКК).

нагревая жир в щелочной среде.
R ’/ R ’’/ R — УВ радикалы(могут быть одинаковые или различные)
Французский химик Бертло в 1854 году впервые синтезировал жир.

Реакция Шевреля( гидролиз): жир+ вода= многоатомный спирт + ВКК
!Реакция в прямом направление-этерификация, а в обратном -гидролиз.
Различают твёрдые жиры и жидкие(масла). В состав твёрдых жиров входят предельные карбоновые кислоты, а в состав жидких-непредельные карбоновые кислоты.
Наиболее часто встречающиеся жиры:
С 15 H 31 COOH ( пальмитиновая кислота)
С 17 H 33 COOH( олеиновая кислота), содержит одну = связь
С 17 H 31 COOH( линолевая кислота), содержит две = = связи
С 17 H 29 COOH( линоленовая кислота), содержит три = = = связи
Содержат остатки предельных ВКК
Содержат остатки непредельных ВКК
Исключение: рыбий жир
Исключение: кокосовое масло(пальмовое масло)
Жиры- вязкие жидкости или твёрдые вещества, легче воды, в воде нерастворимы жидкие жиры , но растворимы в органических растворителях(бензине, бензоле); твёрдые жиры в воде хорошо растворимы.
Характерны реакции присоединения, обесцвечивают бромную воду.
1) Гидрирование( из жидких жиров получают твёрдые сложные эфиры). Из растительного масла при помощи данной реакции получают маргарин.

а) Обратимый водный гидролиз


натриевые соли ВКК- это твёрдое мыло
калиевые соли ВКК- жидкое мыло
!Для жиров, содержащих в своей структуре кислотные остатки непредельных карбоновых кислот, очевидно, характерны все качественные реакции на непредельные соединения, а именно — о бесцвечивание ими раствора перманганата калия и бромной воды. Предельные жиры в такую реакцию не вступают. Так, например, жир, представляющий собой триолеат глицерина, вступает в реакцию и с водным раствором перманганата калия и бромной водой, поскольку содержит кислотные остатки непредельной карбоновой кислоты — олеиновой. Напротив, трипальмитат глицерина в подобные реакции не вступает, т.к. не содержит кратных (двойных) углерод-углеродных связей.
Задания ОГЭ по теме Жиры
1) при обычных условиях — твердые вещества
2) входят в состав растительных и животных организмов
3) растворяются в воде
4) обладают моющими свойствами
5) являются одним из источников энергии для живых организмов
2. Свойства стеариновой кислоты:
1) хорошо растворима в воде
2) при обычных условиях представляет собой твёрдое вещество
3) молекула содержит атомы четырёх элементов
4) является сильной кислотой
5) реагирует с кислородом
Белки — природные высокомолекулярные соединения, состоящие из остатков ἀ-аминокислот. Между собой ἀ-аминокислоты
соединены пептидной связью. Молекула белка может содержать от 100 до нескольких тысяч аминокислотных остатков. В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма. Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка. Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Белки вступают в реакции окисления-восстановления, этерификации, алкилирования, нитрования, могут образовывать соли как с кислотами, так и с основаниями(т.е. амфотерны).
Химические свойства белков
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH 2 O => смесь из α-аминокислот
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией.
Денатурация белка может протекать под действием растворов солей натрия, калия или аммония — такая денатурация является обратимой: Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Ксантопротеиновая реакция (ярко- жёлтое окрашивание при взаимодействии с концентрированной HNO 3 ).
раствор белка + HNO 3(конц.) => желтое окрашивание
Биуретовая реакция ( ярко- фиолетовое окрашивание с концентрированными растворами CuSO 4 и NaOH ).
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + N аОН (10%-ный р-р) + С uSO 4 = фиолетовое окрашивание
Биологические функции белков
1. каталитическая ускоряют различные химические реакции в живых организмах ферменты
2. структурная строительный материал клеток коллаген, белки клеточных мембран
3. защитная защищают организм от инфекций иммуноглобулины, интерферон
4. регуляторная регулируют обменные процессы гормоны
5. транспортная перенос жизненно-необходимых веществ от одних частей организма к другим гемоглобин переносит кислород
6. энергетическая снабжают организм энергией 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж
7. моторная (двигательная) любые двигательные функции организма миозин (мышечный белок)
Углеводы . Формально углеводы- соединения углерода С и воды, отсюда и название-углеводы.

Простые углеводы (моносахариды) -это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов
Сложные углеводы(дисахариды, полисахариды) — это углеводы, молекулы которых состоят из двух и большего числа остатков моносахаридов и разлагаются на моносахариды при гидролизе.
Как можно заметить, и в молекуле глюкозы, и в молекуле фруктозы присутствует по 5 гидроксильных групп, в связи с чем их можно считать многоатомными спиртами. В составе молекулы глюкозы имеется альдегидная группа, т.е. фактически глюкоза является многоатомным альдегидоспиртом. В случае фруктозы можно обнаружить в ее молекуле кетонную группу, т.е. фруктоза является многоатомным кетоспиртом.
Химические свойства моносахаридов(простых углеводов):
Моносахариды(глюкоза, фруктоза) содержат карбонильную(т.е альдегидную группу -СОН) и гидроксильную группу(ОН). Реакции по гидроксильным группам характеризуют глюкозу, как многоатомный спирт. Реакции брожения глюкозы приводят к получению этанола(спирта), молочной, масляной кислот.
1. Взаимодействие с аммиачным раствором оксида серебра ( в результате реакции карбонильная группа (-СОН) превращается в карбоксильную(-СООН)
2. Взаимодействие со свежеприготовленным гидроксидом меди ( II ) при нагревании ( в результате реакции карбонильная группа переходит в карбоксильную и С u ( OH ) 2 ↓ осадок голубого цвета при нагревании переходит в С u 2 О↓ осадок красного цвета.
3. Восстановление(+Н 2 (гидрирование)) глюкозы даёт шестиатомный спирт-сорбит.
4. Брожение глюкозы и фруктозы
Брожение- это расщепление моносахаридов под
влиянием биологических катализаторов-ферментов, вырабатываемых микроорганизмами.
Название вида брожения определяется названием образующихся продуктов брожения.
Гидролиз дисахаридов происходит в кислой среде под действием ферментов:
сахароза(тростниковый сахар), мальтоза( солодовый сахар),лактоза( молочный сахар).
Дисахариды — типичные сахароподобные углеводы; твёрдые кристаллические вещества, хорошо растворимые в воде, имеющие сладкий вкус.
Дисахариды, являясь многоатомными спиртами, дают соответствующую качественную реакцию с гидроксидом меди (II), т.е. при добавлении их водного раствора ко свежеосажденному гидроксиду меди (II) нерастворимый в воде голубой осадок Cu(OH) 2 растворяется с образованием темно-синего раствора.
Полисахариды — сложные углеводы, молекулы которых состоят из большого числа остатков моносахаридов, связанных между собой гликозидными связями. Есть и другое определение полисахаридов: Полисахаридами называют сложные углеводы, молекулы которых образуют при полном гидролизе большое число молекул моносахаридов.
Важнейшие природные представители: крахмал, гликоген, целлюлоза. Это природные полимеры (ВМС), мономером которых является глюкоза. Их общая формула( С 6 Н 10 О 5 ) n
Крахмал- аморфный порошок белого цвета, без вкуса и запаха, плохо растворим в воде, в горячей воде образует коллоидный раствор. Крахмал образуется из углекислого газа и воды в процессе фотосинтеза в зеленых частях растений под действием энергии солнечного света. В наибольших количествах крахмал содержится в картофельных клубнях, пшеничных, рисовых и кукурузных зернах. По этой причине указанные источники крахмала и являются сырьем для его получения в промышленности.
Целлюлоза — вещество, в чистом состоянии представляющее собой белый порошок, не растворимый ни в холодной, ни в горячей воде. В отличие от крахмала целлюлоза не образует клейстер. Практически из чистой целлюлозы состоит фильтровальная бумага, хлопковая вата, тополиный пух. И крахмал, и целлюлоза являются продуктами растительного происхождения.
Однако, роли, которые они играют в жизни растений, различны. Целлюлоза является в основном строительным материалом, в частности, главным образом ей образованы оболочки растительных клеток. Крахмал же несет в основном запасающую, энергетическую функцию.
Химические свойства крахмала и целлюлозы:
Все полисахариды, в том числе крахмал и целлюлоза, при полном сгорании в кислороде образуют углекислый газ и воду:
2)Образование глюкозы При полном гидролизе как крахмала, так и целлюлозы образуется один и тот же моносахарид — глюкоза:
3) Качественная реакци
(С 6 Н 10 О 5 ) n + I 2 => комплексное соединение сине-фиолетового цвета.
При нагревании окрашивание исчезает( комплекс разрушается), при охлаждении появляется вновь.
При сухой перегонке целлюлозы, в частности древесины, происходит ее частичное разложение с образованием таких низкомолекулярных продуктов как метиловый спирт, уксусная кислота, ацетон и т. д.
Поскольку и в молекулах крахмала, и в молекулах целлюлозы имеются спиртовые гидроксильные группы, данные соединения способны вступать в реакции этерификации как с органическими, так и с неорганическими кислотами.
Глюкоза используется в медицине, кондитерском деле, пивоварении( спиртовое брожение глюкозы), целлюлоза- в производстве бумаги, ваты,шёлка.
Качественные реакции органических соединений
Качественной реакцией на алкены, алкины, алкадиены, фенол, анилин является обесцвечивание бромной воды:
Качественной реакцией на алкены и алкины является изменение окраски перманганата калия ( бурый осадок MnO 2 ):


Качественной реакцией на многоатомные спирты является взаимодействие с гидроксидом меди( II ) — нерастворимый в воде осадок голубого цвета растворяется в глицерине и этиленгликоле с образованием ярко-синего раствора глицерата меди( II ).
ярко-синего раствора глицерата меди( II ).
Качественной реакцией на крахмал является его взаимодействие с йодом — происходит интенсивное синее окрашивание , которое можно наблюдать, если например, на срез картофеля или ломтик белого хлеба капнуть раствор йода.
Источник























