- Вода: строение и свойства
- Физические свойства
- Химические свойства
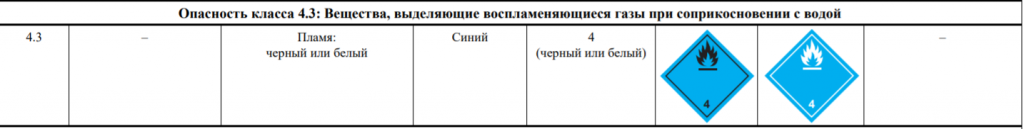
- КОРРОЗИОННАЯ ЖИДКОСТЬ, РЕАГИРУЮЩАЯ С ВОДОЙ, Н.У.К. № ООН 3094
- Жидкость реагирующая с водой
- Физические свойства воды
- Химические свойства воды
- Вода в жизнедеятельности человека. Водные растворы
- Такая разная вода: два жидких агрегатных состояния H2O
- Основа исследования
- Результаты исследования
- Эпилог
- Немного рекламы
Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник
КОРРОЗИОННАЯ ЖИДКОСТЬ, РЕАГИРУЮЩАЯ С ВОДОЙ, Н.У.К. № ООН 3094
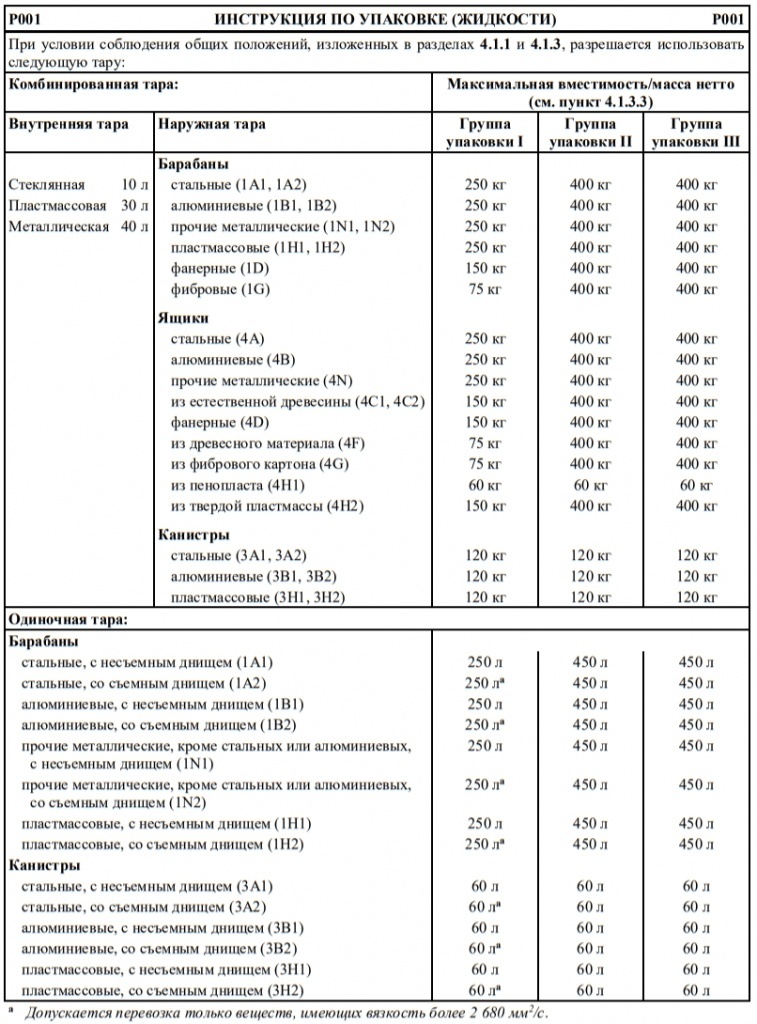
Максимальное количество нетто на внутреннюю тару
(в граммах для твердых веществ и в мл для жидкостей и газов)
Максимальное количество нетто на наружную тару
(в граммах для твердых веществ и в мл для жидкостей и газов либо сумма граммов и мл в случае смешанной упаковки)
Не допускаются в качестве освобожденного количества
Кодирование цистерн. Четыре части кодов (кодов цистерн), указанных в колонке 12 таблицы А главы 3.2, имеют следующие значения:
| Часть | Описание | Код цистерны |
| 1 | Типы цистерн | L = цистерна для веществ в жидком состоянии (жидкостей или твердых веществ, предъявляемых к перевозке в расплавленном состоянии); S = цистерна для веществ в твердом состоянии (порошкообразных или гранулированных). |
| 2 | Расчетное давление | G = минимальное расчетное давление в соответствии с общими требованиями пункта 6.8.2.1.14; или 1,5; 2,65; 4; 10; 15 или 21 = минимальное расчетное давление в барах (см. пункт 6.8.2.1.14). |
| 3 | Отверстия (см. пункт 6.8.2.2.2) | A = цистерна с отверстиями для наполнения снизу или опорожнения снизу, с двумя затворами; B = цистерна с отверстиями для наполнения снизу или опорожнения снизу, с тремя затворами; C = цистерна с отверстиями для наполнения и опорожнения сверху, имеющая ниже уровня жидкости только отверстия для очистки; D = цистерна с отверстиями для наполнения и опорожнения сверху, не имеющая отверстий, расположенных ниже уровня жидкости. |
| 4 | Предохранительные клапаны/устройства | V = цистерна с дыхательным устройством согласно пункту 6.8.2.2.6, но без устройства, предотвращающего распространение пламени; или цистерна, не устойчивая к ударному давлению взрыва; F = цистерна с дыхательным устройством согласно пункту 6.8.2.2.6, оснащенным устройством, предотвращающим от распространения пламени; или цистерна, устойчивая к ударному давлению взрыва; N = цистерна, не имеющая дыхательного устройства согласно пункту 6.8.2.2.6 и не являющаяся герметически закрытой; H = герметически закрытая цистерна (см. раздел 1.2.1). |
| Код цистерны | Группа допущенных веществ | |||
| Класс | Классификационный код | Группа упаковки | ||
| L10BH | 8 | С1 | I | |
| С3 | I | |||
| С4 | I | |||
| С5 | I | |||
| С7 | I | |||
| С8 | I | |||
| С9 | I | |||
| С10 | I | |||
| СF1 | I | |||
| СF2 | I | |||
| CS1 | I | |||
| CW1 | I | |||
| CW2 | I | |||
| CO1 | I | |||
| CO2 | I | |||
| CT1 | I | |||
| CT2 | I | |||
| COT | I | |||
| а также группы веществ, допущенных к перевозке в цистернах под кодами LGAV, LGBV, LGBF, L1,5BN, L4BN и L4BH | ||||
Цистерны с кодами, отличными от тех, которые указаны в этой таблице или в таблице А главы 3.2, могут также использоваться при условии, что каждый элемент (цифра или буква) частей 1–4 этих кодов цистерн соответствует уровню безопасности, по меньшей мере эквивалентному соответствующему элементу кода, указанного в таблице А главы 3.2, согласно следующей возрастающей последовательности:
Примеры: – цистерну с кодом L10CN разрешается использовать для перевозки вещества, которому присвоен код цистерны L4BN; – цистерну с кодом L4BN разрешается использовать для перевозки вещества, которому присвоен код цистерны SGAN7
Часть 1: Типы цистерн
S → L
Часть 2: Расчетное давление
G → 1.5 → 2,65 → 4 → 10 → 15 → 21 бар
Часть 3: Отверстия
A → B → C → D
Часть 4: Предохранительные клапаны/устройства
V → F → N → H.
Примеры:
– цистерну с кодом L10CN разрешается использовать для перевозки вещества,
которому присвоен код цистерны L4BN;
– цистерну с кодом L4BN разрешается использовать для перевозки вещества,
которому присвоен код цистерны SGAN7
ПРИМЕЧАНИЕ: В этой иерархии не учтены какие-либо специальные положения для каждой позиции (см. разделы 4.3.5 и 6.8.4).
Для тех случаев, когда опасные грузы, перевозимые в транспортной единице, относятся к одной и той же категории, в колонке 3 приведенной ниже таблицы указано максимальное общее количество на транспортную единицу.
Источник
Жидкость реагирующая с водой
Ключевые слова конспекта: вода, физические и химические свойства воды, водные растворы.
Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н2О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь: 
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н2O. С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н2O = 2LiOH + Н2↑,
Са + 2Н2O = Са(ОН)2 + Н2↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н2O = ZnO + Н2↑,
3Fe + 4Н2O = Fe3O4 + 4Н2↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи:
Na2O + Н2O = 2NaOH,
СаО + Н2O = Са(ОН)2.
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты:
СO2 + Н2O = Н2СO3,
SO3 + Н2O = H2SO4.
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К2СO3 + Н2O = КНСО3 + КОН,
РСl3 + ЗН2O = Н3РО3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C2H5OH — реакция этилена С2Н4 с водой:
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са 2+ , Mg 2+ , Fe 2+ . Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО3)2, магния Mg(HCO3)2 и железа Fe(HCO3)2. При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO3)2 = СаСО3↓ + СO2↓ + Н2O,
Fe(HCO3)2 = FeCO3↓ + CO2↓ + Н2O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl2 + Na2CO3 = СаСO3↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Конспект урока по химии «Вода. Свойства воды. Водные растворы». Выберите дальнейшее действие:
Источник
Такая разная вода: два жидких агрегатных состояния H2O
Как нам всем известно в природе существует четыре основных агрегатных состояния вещества: твердое, жидкое, газообразное и плазма. Вода, будучи неотъемлемой составляющей и движущей силой жизни на планете, может при разных условиях пребывать в трех состояниях: в жидком, твердом (лед) и газообразном (пар). Однако ученые из Стокгольмского университета (Швеция) выяснили, что у воды имеется два разных жидких состояния. Первое мы наблюдаем на постоянной основе, а вот второе проявляется при температуре -63 °C. Как ученым удалось сделать это открытие, какими свойствами обладает вода во втором жидком состоянии, и какова его роль? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Фундаментом для подобного рода исследований стало обнаружение расхождения изотермической сжимаемости и теплоемкости (CP) при переохлаждении воды. Ученые начали поиски объяснений этих странных процессов.
Одна из самых распространенных теорий утверждает, что существует переход жидкость-жидкость (LLT от liquid-liquid transition) в переохлажденной воде между жидкостью высокой плотности (HDL от high-density liquid) и жидкостью низкой плотности (LDL от low-density liquid), который заканчивается в критической точке жидкость-жидкость (LLCP от liquid-liquid critical point) при положительном давлении. Аномальное поведение воды в соответствии с этой теорией объясняется колебаниями, исходящими от LLCP.
Относительно недавно были проведены дополнительные опыты, в ходе которых было обнаружено, что структура переохлажденной воды непрерывно изменяется при охлаждении до 227 К под давлением 1 бар. Это указывает на однофазное поведение без LLT при атмосферном давлении. Следовательно, это подразумевает, что если LLT действительно существует, то LLCP должен находиться при давлении (P) > 1 бар.
Эксперименты по рассеянию нейтронов в воде позволили предположить, что различные фазы HDL и LDL могут быть идентифицированы по их четко определенным положениям пиков в структурном факторе (математическое описание того, как материал рассеивает падающее излучение).
В частности, положение первого пика в О–О рассеянии сильно чувствительно к существованию тетраэдрических структур (LDL) или межузельных молекул между первой и второй оболочками (HDL). Следовательно, наиболее подходящим способом обнаружения LLT в переохлажденной воде может быть отслеживание структуры жидкости с помощью рассеяния рентгеновских лучей или нейтронов. Основная сложность таких опытов заключается в том, что их нужно проводить при разном давлении и очень быстро, пока не произошла кристаллизация.
В данном труде был использован метод компрессии-декомпрессии, когда начальное повышение давления было вызвано нагревом, индуцированным лазерным импульсом. Когда временной масштаб индуцированного лазером высвобождения энергии намного короче, чем время прохождения звука через образец, нагрев является изохорным*, а давление внутри образца значительно возрастает.
Изопроцесс* — термодинамический процесс, когда количество вещества и какой-то параметр его состояния (давление, объем, температура или энтропия) остаются неизменными.
После окончания сверхбыстрого лазерного импульса образец быстро расширяется по мере того, как внутреннее давление уменьшается, приближаясь к значениям давления окружающей среды. Однако, если динамика жидкости достаточно быстрая, чтобы расслабить образец до наступления расширения, квазиравновесное поведение будет наблюдаться во время процесса декомпрессии.
Образцы изучались с помощью рассеяния рентгеновских лучей с разными временными задержками во время декомпрессии. В ходе наблюдений было выявлено резкое изменение структурного фактора, которое указывает на прерывистый LLT. Кроме того была обнаружена кристаллизация льда, происходящая значительно позднее. Это подтверждает, что LLT является метастабильным состоянием и отличается от перехода жидкость-лед.
Результаты исследования
Аморфный лед* получают посредством быстрого охлаждения воды, так что ее молекулы не успевают сформировать кристаллическую решетку (т.е. молекулы расположены случайным образом).

Изображение №1
Толщина выбранных для наблюдения образцов варьировалась либо от 35 до 55 мм, либо от 15 до 25 мм. На образец воздействовал инфракрасный импульс с длиной волны 2 мм в течение 100 фс. Импульс увеличивал температуру и возбуждал комбинацию O–H и H–O–H.
ИК импульс с длиной волны 2 мм может перегреть и частично растопить лед за 10 нс. Такое частичное плавление наблюдалось для гексагонального образца льда (Ih) толщиной 100 мм (1B). Когда эквивалентный нагрев был применен к образцам HDA (толщиной 3 , а изохорный нагрев поддерживал плотность сразу после ИК-накачки. Измерение плотности и температуры переохлажденной воды в зависимости от давления после воздействия ИК импульса показало, что значения давления составляли от 2.5 до 3.5 кбар.
После активации ИК импульса началась самопроизвольная декомпрессия, во время которой температура оставалась примерно постоянной, пока через
100 мс охлаждение за счет теплопроводности не стало существенным.
Данная изотермическая декомпрессия снижала давление в образце. В этот момент проводили измерения с помощью интенсивных импульсов рентгеновского излучения -1 , что согласуется с ранее проведенными исследованиями HDA.
Через 8.4 нс после подачи ИК импульса образцы подверглись нагреву. В этот момент было замечено, что положение пика оставалось постоянным и близким к положению пика жидкой воды при 300 К и давлениях от 2 до 3 кбар. Через 16.8 нс на графике появляется плечо при q = 1.7 Å -1 , что аналогично положению q для LDA и LDL. Интенсивность этого пика увеличивалась по мере продолжения декомпрессии до временной задержки в 3 мс. При более длительных задержках (от 3 мс до 1 мс) наблюдалось развитие пиков Брэгга, соответствующих фазе льда Isd, которые увеличивались со временем. При окончательном измерении временной задержки (1 мс) все образцы превращались в лед.
На графике 2В показаны временные задержки для образцов толщиной от 15 до 25 мм, где степень преобразования HDL в LDL была выше, чем у образцов с большей толщиной. Спустя 1 мс соотношение двух компонентов составляет почти 1:1. Это, вероятнее всего, связано с тем, что в более тонких образцах процесс нагрева протекает более равномерно. В более толстых образцах ИК излучение поглощается больше на передней поверхности, чем на задней, что приводит к большему градиенту температур. Две наблюдаемые взаимопревращающие фазы имеют q-положения вблизи HDL и LDL, как и было предсказано на основе экстраполяции данных по зависящему от температуры и давления рассеянию нейтронов водой при более высоких температурах.
Сценарии, показанные на 1D—1F, могут быть только в том случае, если образец после ИК импульса был жидкостью, а не аморфным твердым телом, и оставался жидким во время процесса декомпрессии.
Сразу после ИК импульса образец перемещался в точку на фазовой диаграмме, лежащую выше температуры гомогенного образования льда (TH), что соответствует быстрой жидкоподобной диффузии. В этой области вода была метастабильной жидкостью в течение нескольких минут, прежде чем превратилась в кристаллические фазы льда.
Чтобы понять, как сразу после нагрева HDA ИК импульсом возникает жидкоподобная диффузия, ученые метод классической молекулярной динамики для модели воды ST2 (исследование по данной теме доступно по ссылке: Improved simulation of liquid water by molecular dynamics).
Наблюдаемое температурное смещение в 25 К означает, что экспериментальная температура 205 К соответствует
230 К для ST2 воды.
Изображение №3
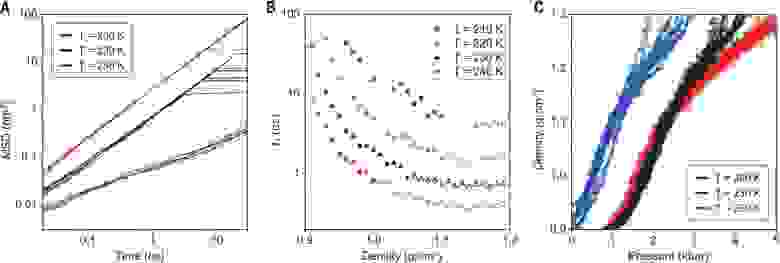
На 3А показано среднеквадратичное смещение (MSD) молекул ST2 как функция времени после быстрого нагревания (при 3000 К/нс) образца HDA. Начиная с 80 К, HDA нагревали до одной из трех различных конечных температур в диапазоне от 200 до 250 К. Если бы была задержка для перехода образца в жидкое состояние, то среднеквадратичное смещение было бы изначально постоянным, а затем линейно увеличивался бы после задержки.
В ходе моделирования системы было обнаружено, что среднеквадратичное смещение увеличивается со временем линейно, как и ожидалось для диффундирующей жидкости. Из этих результатов следует, что в течение 20 пс после быстрого нагрева HDA в системе образуется жидкое состояние. Этот процесс был намного быстрее, чем частичное таяние льда фазы Ih посредством ИК импульса, которое длилось
Тем не менее травление кристаллов, т.е. переход между фазами со значимыми отличиями в структурах до и после, является процессом, требующим активации (т.е. преодоления барьера свободной энергии).
Используемые в опытах образцы льда выдерживали от 0.5 до 5 часов при температуре 115 К, потому они еще до нагрева находились в ультравязком жидком состоянии. Образцы не столкнулись с барьером свободной энергии при нагревании от 115 до 205 К. Это согласуется с тем, что HDA и HDL структурно тесно связаны, и в результате начало быстрой диффузии было моментальным.
Коэффициент диффузии (D) для жидкой воды при 205 К и 3 кбар, полученный при анализе экспериментальных данных, составил D = 2 х 10 -11 м 2 /с. Дабы преобразовать D в показатель времени для жидкоподобной диффузии, необходимо было сначала определить t1 = (1 nm 2 )/6D, где t1 — среднее время, необходимое среднеквадратичному смещению для достижения 1 нм 2 , что эквивалентно диффузии, превышающей диаметр молекулы воды в три раза. Расчеты и наблюдения показали, что сразу после ИК импульса t1 составляет 8 нс. Для ST2 модели, когда температура системы была в диапазоне от 220 до 240 К, а плотность 1.2 г/см 3 , время t1 составляло от 0.5 до 2 нс (3B). Даже после самой короткой временной задержки, образец, полученный после ИК импульса, имел достаточно времени, чтобы перейти в жидкое состояние HDL.
Временной показатель жидкоподобной релаксации в областях низкой плотности, образовавшихся в образцах при декомпрессии, можно было оценить несколькими способами. Предыдущие измерения в тонких слоях LDL воды при 1 бар и 205 К показали D = 2 х 10 -13 м 2 /с, что соответствует t1 = 800 нс. Это примерно в 100 раз больше, чем у HDL, образовавшихся после ИК импульса. В соответствии с этими данными было установлено, что для ST2 воды t1 увеличивался примерно в 50 раз, когда система преобразовывалась из чистого HDL в чистый LDL (3B). Также было выявлено моментальное изменение плотности ST2 модели при T > 200 К во время быстрой декомпрессии (3С).
Эксперименты и моделирование показали, что жидкостное равновесие системы при 205 К в LDL образовывалось за время в 50-100 раз большее, чем для HDL. Следовательно, если есть возможность достичь жидкостного равновесия в течение нескольких наносекунд, то этого же можно достичь и в течении сотен наносекунд. Если это так, то отдельные фазы с высокой и низкой плотностью, наблюдаемые в субмикросекундном временном масштабе, можно воспринимать как квазиравновесные жидкие фазы.
При учете сценариев, показанных на 1С—1Е, должно происходить быстрое преобразование в лед или непрерывное преобразование жидкого состояния. Однако этого не происходило. Образование кристаллического льда могло бы происходить в масштабах времени, более чем на один порядок превышающих преобразование в LDL. Из этого следует, что экспериментальные данные могут быть количественно согласованы только со сценарием, показанным на 1F.

Изображение №4
Дабы лучше понять, как происходит образование LLT, были проанализированы отличия в рассеянии для образцов разной толщины (от 35 до 55 мм). Это позволило оценить фракционную заселенность каждой фазы в образце как функцию временной задержки (4A).
На 16.8 нс наблюдается лишь небольшая доля LDL, которая достигала максимума (
40% от общей интенсивности рассеяния) спустя 3 мс. Этот процесс сопровождается соответствующим уменьшением доли HDL. На временной отметке в 3 мс появляется кристаллический лед, который в последствии преобладает по всей системе. Образование льда происходило во временном масштабе, более чем на один порядок превышающем переход от HDL к LDL. Это указывает на то, что LLT, хоть и является метастабильным фазовый переход, он все же отличается от перехода жидкость-лед.
Из-за динамического характера процесса декомпрессии ожидалось, что преобразование HDL в LDL будет происходить в области на графике между линией HDL-LDL сопряжения и пределом метастабильности фазы HDL. В этой области переход должен проявляться в короткие промежутки времени в виде локализованных LDL флуктуаций, за которыми следует зарождение и рост LDL доменов. На 4В (график малоуглового рентгеновского рассеяния, SAXS) отчетливо видны небольшие флуктуации LDL.
Полное преобразование образца в LDL было прервано процессом образования льда. Однако для тонких образцов соотношение HDL:LDL достигало значения 1:1 за 1 мс до появления льда (2В).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном труде ученые установили наличие второго жидкого состояния для воды, возникающего при 205 К. Результаты экспериментов показали, что переход жидкость-жидкость (LLT) происходит в условиях (давление и температура), при которых обычно происходит только кристаллизация.
Кроме того, наблюдаемый для LLT временной масштаб (от наносекунд до микросекунд), согласуется с предыдущей экспериментальной оценкой, основанной на экстраполяциях от 10 мс при 174 К до наносекунд и микросекунд при 220 К с использованием температурно-зависимых кинетических измерений.
Ученые отмечают, что ранее подобных наблюдений не было ввиду отсутствия соответствующего оборудования. В современных лабораториях есть возможность проводить рентгеновские исследования процессов, которые протекают молниеносно. В добавок к этому существует множество методик моделирования, позволяющих предугадать ход исследуемых процессов до фактических наблюдений. Фактор скорости крайне важен, когда речь идет об исследовании воды в момент ее преобразования в лед. За счет «быстрых» рентгеновских лучей ученым удалось наблюдать процесс преобразования одной жидкости в другую, что предшествует образованию льда. Следовательно, при определенных условиях вода из жидкого состояния переходит в другое жидкое состояние.
Результаты этого колоссального труда открывают новые возможности перед исследователями воды, позволяя разрешить многолетние споры вокруг живительной жидкости и ее необычных свойств.
В будущем ученые намерены провести дополнительные исследования своего открытия, поскольку остается еще немало вопросов касательно свойств второго жидкого состояния воды и его важности в процессах, протекающих на планете. По некоторым предположениям наличие двух жидких фаз воды может каким-то образом быть связано с биологическими процессами в живых клетках.
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята. 🙂
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Источник